
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量CuSO4溶液 | B. | 加入少量K2SO4溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 将稀硫酸换为浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在氧气中的燃烧 | |
| D. | 白磷自燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应达到平衡后,其他条件不变,只改变压强,平衡不移动 | |
| B. | 上述反应过程中的平均相对分子质量增大 | |
| C. | 单位时间内反应物浓度的减少等于生成物浓度的增加 | |
| D. | 若在前10s内B减少了xmol,则在前20s内A减少小于2xmol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
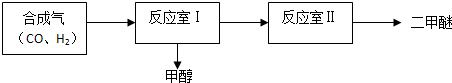
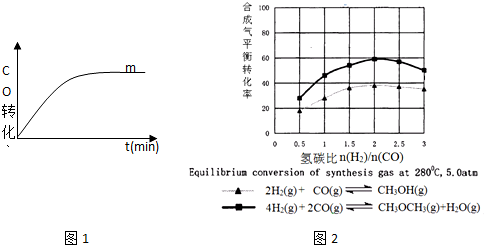
| 序号 | 温度(°C) | 起始浓度(mol•L-1) | 平衡浓度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com