
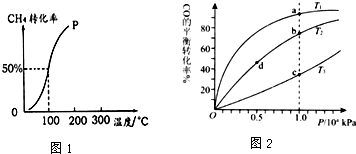
分析 (1)①由图可知,温度越高,转化率越大;
②100℃时达到平衡所需的时间为3min,甲烷转化率为50%,则生成氢气为1.5mol,结合v=$\frac{△c}{△t}$计算;
③CH4 ( g )+H2O ( g )?CO ( g )+3H2 ( g )
开始 0.1 0.2 0 0
转化 0.05 0.05 0.05 0.15
平衡 0.05 0.15 0.05 0.15
结合平衡浓度计算K;
④结合平衡的特征“等、定”及衍生的物理量判定;
(2)A.该反应为放热反应,温度越低,转化率越低;
B.a、c温度不同,b、d压强不同,温度越大压强越大,反应速率越快;
C.K只与温度有关,温度越高,放热反应的K越小;
D.质量不变,CO的转化率越大,平衡后气体的物质的量越小,则M越大;
(3)由CH3OH(g)?CO(g)+2H2(g)可知,△H>0,△S>0,以此来解答.
解答 解:(1)①由图可知,温度越高,转化率越大,则升高温度平衡正向移动,该反应的△H>0,故答案为:>;
②100℃时达到平衡所需的时间为3min,甲烷转化率为50%,则生成氢气为1.5mol,用H2表示该反应的平均反应速率为$\frac{\frac{1.5mol}{10L}}{3min}$=0.05mol/(L•min),
故答案为:0.05;
③CH4 ( g )+H2O ( g )?CO ( g )+3H2 ( g )
开始 0.1 0.2 0 0
转化 0.05 0.05 0.05 0.15
平衡 0.05 0.15 0.05 0.15
K=$\frac{0.05×0.1{5}^{3}}{0.05×0.15}$=0.0225,
故答案为:0.0225;
④A.CO的含量保持不变,为平衡状态,故A选;
B.CH4浓度与CO浓度相等,与转化率、起始量有关,不能判断平衡状态,故B不选;
C.ν正(CH4)=3ν逆(H2),正逆反应速率不等,故C不选;
D.混合气体的密度始终保持不变,不能判定平衡状态,故D不选;
E.该反应为气体物质的量不等的反应,混合气体的总物质的量保持不变,为平衡状态,故E选;
F.该反应为气体物质的量不等的反应,混合气体的压强度保持不变,为平衡状态,故F选;
故答案为:AE;
(2)A.该反应为放热反应,温度越低,转化率越低,则温度:T2>T2>T1,故A错误;
B.a、c温度不同,b、d压强不同,温度越大压强越大,反应速率越快,则正反应速率:ν(a)<ν(c)、ν(b)>ν(d),故B错误;
C.K只与温度有关,温度越高,放热反应的K越小,则平衡常数:K(a)>K(c)、K(b)=K(d),故C正确;
D.质量不变,CO的转化率越大,平衡后气体的物质的量越小,则M越大,则平均摩尔质量:M(a)>M(c)、M(b)>M(d),故D正确;
故答案为:CD;
(3)由CH3OH(g)?CO(g)+2H2(g)可知,△H>0,△S>0,△H-T△S<0的反应可自发进行,则此反应能自发进行的原因是该反应是一个熵增的反应 (△S>0),故答案为:该反应是一个熵增的反应.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡移动,反应进行方向为解答的关键,侧重分析与计算能力的考查,注意图象与平衡移动的结合,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热不会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为75%
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素.M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com