
【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
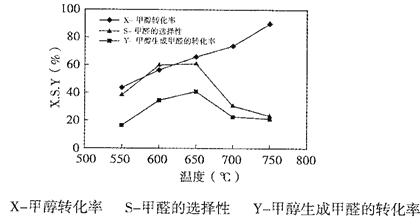
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
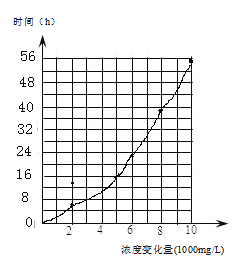
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。
【答案】-156.6 kJ/mol P0(1+α) 50.5 甲醇脱氢反应为吸热反应,升高温度,有利于脱氢反应向正反应方向进行 < < 84.6 16
【解析】
(1)根据盖斯定律计算;
(2)列出三段式计算。
(3)①从甲醇脱氢反应为吸热反应的角度分析;②该反应的活化能小于总反应的活化能;③由图可知650℃~750℃,甲醇的转化率变大,但甲醛的选择性变小,由此比较。
(4)代入v=0.0423c(mg·L-1·h-1)计算;画出甲醛浓度减少量和时间关系图解答。
(1)反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
根据盖斯定律计算:计算反应Ⅱ的反应热△H2=-△H1+△H3=-241.8kJ·mol-1+85.2kJ·mol-1=-156.6 kJ/mol;
(2)若起始压强为P0,达到平衡转化率为α,
CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
起始量(mol):1 0 0
变化量(mol):a a a
平衡时(mol):1-a a a
压强之比等于物质的量之比,则p0:P平=1:(1+a),P平=p0(1+a);
当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=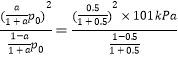 =50.5kPa;
=50.5kPa;
(3)①从平衡角度可知,550℃-650℃甲醇生成甲醛的转化率随温度升高的原因是:甲醇脱氢反应为吸热反应,升高温度,有利于脱氢反应向正反应方向进行;
②由盖斯定律,历程i+历程ⅱ+历程iv得CH3OH(g)![]() HCHO(g)+H2(g),前两者吸收能量,历程iv放出能量,总反应CH3OH(g)
HCHO(g)+H2(g),前两者吸收能量,历程iv放出能量,总反应CH3OH(g)![]() HCHO(g)+H2(g)是吸热反应,故历程i的活化能小于总反应的活化能。
HCHO(g)+H2(g)是吸热反应,故历程i的活化能小于总反应的活化能。
③由图可知650℃~750℃,甲醇的转化率变大,但甲醛的选择性变小,反应历程ii的速率小于反应历程ⅲ的速率。
(4)当甲醛浓度为2000mg/L时,,吹脱速率v=0.0423c(mg·L-1·h-1)=0.0423×2000(mg·L-1·h-1)=84.6mg·L-1·h-1;
根据甲醛浓度减少量和时间之间关系作图:从图中读出当甲醛浓度减少量为5000mg·L-1时,所耗时间约为16h。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)保持100℃的恒温,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____________________。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”,“中性”或“碱性”),醋酸体积____________氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,上述离子浓度大小关系中正确的是(选填字母)________。
②若上述关系中D是正确的,则溶液中的溶质为____________________;
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)= _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的电化学脱硫是借助煤在电解槽阳极发生的电化学氧化反应,将煤中黄铁矿(FeS2)或有机硫化物氧化成可溶于水的含硫化合物而达到净煤目的,下图是一种脱硫机理,则下列说法正确的是
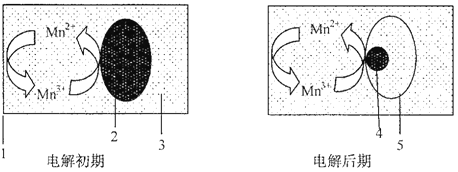
l—电极a 2—黄铁矿 3—MnSO4、H2SO4混合溶液 4—未反应黄铁矿 5一电解产品
A. Mn3+充当了电解脱硫过程的催化剂
B. 电极a应与电源负极相连
C. 脱硫过程中存在的离子反应为:8H2O+FeS2+15Mn3+=Fe3++16H++2SO42-+15Mn2+
D. 阴极发生的反应:2H2O+2e-=4H++O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1000mol/L的NaOH溶液分别滴加到20.00mL浓度均为0.1000mol/L的一元酸HX和HY溶液中,溶液的pH与所加NaOH体积的关系如图所示,下列叙述错误的是
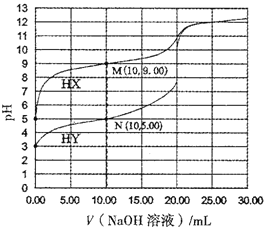
A. N点溶液中c(Y-)>c(Na+)>c(OH-)>c(H+)
B. 常温下,0.1000mol/LHY溶液的电离度约为1%
C. Ka(HX)数量级为10-9
D. 用NaOH溶液滴定HY可用酚酞做指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,18g的D2O含有的中子数、电子数均为10NA
B. 1.0 mol/L的FeCl3溶液中Fe3+的个数小于NA
C. 标准状况下,2.24 L甲醛中碳氢键的数目为0.2NA
D. 密闭容器中,加入2molHI,发生反应:2HI(g) ![]() H2(g)+I2(g),达到平衡后气体分子总数小于2NA
H2(g)+I2(g),达到平衡后气体分子总数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
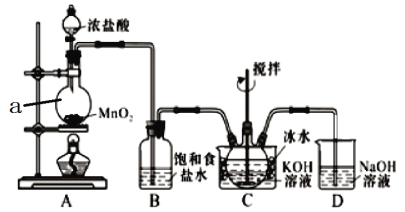
(査阅资料)① Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;② K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是_________;装置A中反应的化学方程式为__________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是_________________________________。
(3)装置B吸收的气体是_________,装置D的作用是___________________________。
(4)C中得到足量KC1O后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为__________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是___________。
(6)若实验中消耗了VmL c mol/L的Fe(NO3)3溶液,Fe(NO3)3充分反应,最终制得a g的K2FeO4固体,则本实验K2FeO4的产率为 ______________(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
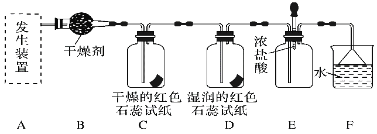
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。已知:制取氨气的反应原理为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O

[实验探究]
(1)利用上述原理,实验室制取氨气应选用下图中________(填序号)发生装置进行实验。
(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”)。
(4)F装置中倒置漏斗的作用是___________________________________。
(5)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜![]() 铜绿
铜绿![]() ……
……![]() 铜”的转化。
铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?____。
(2)写出B的化学式____。
(3)上述转化过程中属于置换反应的是____(填序号)。
(4)写出①反应的化学方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com