
【题目】现有下列九种物质:①HCl气体 ②Cu ③蔗糖 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氯酸钾溶液 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)属于电解质的是___;属于非电解质的是___。
(2)②和⑧反应的化学方程式为:3Cu +8HNO3=3Cu(NO3)2+2NO↑+4H2O
上述反应中氧化产物是___。硝酸没有全部参加氧化还原反应,参加氧化还原反应的硝酸占总硝酸的___。用双线桥法分析上述反应(只需标出电子得失的方向和数目)___。3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(4)⑨在水中的电离方程式为___,
(5)34.2g⑨溶于水配成1000mL溶液,SO42-的物质的量浓度为___。
【答案】①⑤⑥⑨ ③④ Cu(NO3)2或Cu2+ 25% 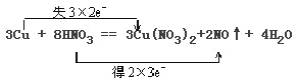 Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Al2(SO4)3=2Al3++3SO42- 0.3mol/L
Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Al2(SO4)3=2Al3++3SO42- 0.3mol/L
【解析】
(1)在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;在水溶液里和熔融状态下都不能导电的化合物是非电解质,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(2)氧化还原反应中所含元素化合价升高的反应物为还原剂,对应产物为氧化产物;依据硝酸中氮元素化合价的变化计算参加氧化还原反应的硝酸占总硝酸的量;根据Cu元素的化合价变化、N元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数;
(3)H++OH-═H2O,可以表示强酸与强碱反应生成可溶性盐和水;
(4)硫酸铝为强电解质,水溶液中完全电离;
(5)计算3.42g硫酸铝的物质的量,依据硫酸铝电离方程式计算硫酸根离子的物质的量,依据![]() 计算硫酸根离子的物质的量浓度。
计算硫酸根离子的物质的量浓度。
(1)①HCl气体是在水溶液里能导电的化合物,是电解质;
②Cu是单质,既不是电解质也不是非电解质;
③蔗糖是在水溶液里和熔融状态下都不能导电的化合物,是非电解质;
④CO2本身不能电离,属于非电解质;
⑤H2SO4是在水溶液里能导电的化合物,是电解质;
⑥Ba(OH)2固体是在水溶液里或熔融状态下能够导电的化合物,是电解质;
⑦氯酸钾溶液是混合物,既不是电解质也不是非电解质;
⑧稀硝酸是混合物,既不是电解质也不是非电解质;
⑨熔融Al2(SO4)3是在水溶液里或熔融状态下能导电的化合物,是电解质;
综上所述,属于电解质的是①⑤⑥⑨;属于非电解质的是③④;
故答案为:①⑤⑥⑨;③④;
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,反应中铜元素化合价升高,为还原剂,对应产物硝酸铜为氧化产物,参加反应的硝酸有8mol,只有2mol硝酸中的N化合价降低,作氧化剂,参加氧化还原反应的硝酸占总硝酸的25%;在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e,则用双线桥法标出电子得失的方向和数目为,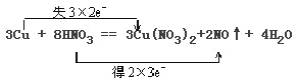 ;
;
故答案为:Cu(NO3)2或Cu2+;25%; ;
;
(3)H++OH═H2O,可以表示稀硝酸与氢氧化钡反应,化学方程式为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(4)硫酸铝为强电解质,完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(5)3.42g硫酸铝的物质的量![]() ,依据硫酸铝电离方程式:Al2(SO4)3=2Al3++3SO42-,可知硫酸根离子的物质的量为0.03mol,则硫酸根离子的物质的量浓度
,依据硫酸铝电离方程式:Al2(SO4)3=2Al3++3SO42-,可知硫酸根离子的物质的量为0.03mol,则硫酸根离子的物质的量浓度![]() ;
;
故答案为:0.3mol/L。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 代表阿伏加德罗常数的值,下列叙述正确的是( )
代表阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol ![]() 中含有
中含有![]() 个
个![]()
B.4.6g分子式为![]() 的有机物中碳氢键数目一定是
的有机物中碳氢键数目一定是![]()
C.电解精炼铜中转移1mol电子,阳极质量减少32g
D.将含0.1mol![]() 的饱和溶液滴入沸水中,形成的胶体粒子的数目少于
的饱和溶液滴入沸水中,形成的胶体粒子的数目少于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜为白色粉末状固体,难溶于水和乙醇,潮湿时易被氧化,可用作催化剂、杀菌剂、媒染剂等。工业以硫化铜精矿为原料,制备氯化亚铜的流程如图:
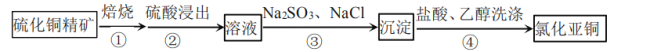
下列说法正确的是( )
A.步骤①焙烧产生的有毒气体可用碱液吸收
B.步骤②所用硫酸浓度越大浸出速率越快
C.步骤③离子方程式:![]()
D.步骤④用乙醇洗涤的目的是使![]() 尽快干燥,防止被空气氧化
尽快干燥,防止被空气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
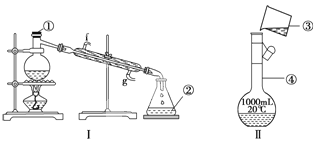
(1)写出下列仪器的名称:①__________,②__________,
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有______________,将仪器补充完整后进行的实验操作的名称为____________;
(3)用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
①应称取Na2CO3·10H2O晶体的质量:__________。
②所用仪器除托盘天平、烧杯、玻璃棒、药匙、量筒外,还需要__________(填仪器名称)。
③根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
A.Na2CO3·10H2O晶体失去了部分结晶水 |
B.用“左码右物”的称量方法称量晶体(使用游码) |
C.称量碳酸钠晶体时所用砝码生锈 |
D.容量瓶未经干燥使用 |
其中引起所配溶液浓度偏高的有___________(填字母)
④装置Ⅱ是某同学转移溶液的示意图,图中的错误是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的质子数为NA
C. 常温常压下,46gNO2含有的原子总数为3NA
D. 标况下,4.48LH2O中含有氢原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲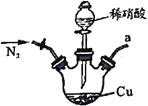 乙
乙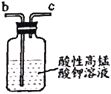 丙
丙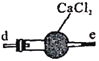 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,组成一个原电池。
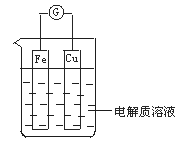
(1)当电解质溶液为稀硫酸时:
①Fe电极是__(填“正”或“负”)极,其电极反应为___。
②Cu电极是__极,其电极反应为___。
(2)由铜、锌和稀硫酸组成的原电池中,铜是__极,电极反应式是__;锌是__极,电极反应式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com