
| A、50 mL 1 mol?L-1KCl溶液 |
| B、25 mL 2 mol?L-1Ca(Cl)2溶液 |
| C、150 mL 3 mol?L-1KCl溶液 |
| D、50 mL 1 mol?L-1 MgCl2溶液 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、溴水中平衡:Br2+H2O?HBr+HBrO 当加入NaOH溶液后颜色变浅 |
| B、对2HI?H2+I2(g)平衡体系增加压强使颜色变深 |
| C、反应CO+NO2?CO2+NO△H<0 升高温度使平衡向逆方向移动 |
| D、合成氨:N2+3H2?2NH3,△H<0 为提高产率,理论上应低温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、复分解反应一定不是氧化还原反应 |
| B、置换反应一定是氧化还原反应 |
| C、有单质参加的化合反应一定是氧化还原反应 |
| D、没有单质生成的分解反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸的摩尔质量63g |
| B、1mol CO的体积约为22.4L |
| C、2g氢气所含原子数目为1mol |
| D、铁的摩尔质量在数值上等于铁原子的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤ | B、①④ | C、③④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中滴加氢氧化钡溶液至SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+1AlO2-+2H2O |
| B、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3?H2O |
| C、磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
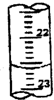 某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol?L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com