
分析 (1)氮原子核电核数为7,两个电子层,最外层5个电子,据此确定周期表中的位置;
(2)①根据氮原子和氢原子个数之间的关系确定氢化物的通式;
②依据氮原子的连接方式书写同分异构体;
(3)对应的酸越强,则酸根离子得到质子的能力越弱,依据信息分析判断原因;
(4)用N2H4与NO2可组合制成燃料电池,产物中无污染物,即为氮气和水,原电池的正极上发生得电子的还原反应;
(5)每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ.
解答 解:(1)氮原子核电核数为7,两个电子层,最外层5个电子,位于第二周期,第ⅤA族,
故答案为:二,ⅣA;
(2)①根据氮原子和氢原子个数之间的关系:氢原子个数比氮原子个数多2,所以通式表示为:NnHn+2(n≥2),
故答案为:NnHn+2(n≥2);
②N4H6的同分异构体为 、NH2-NH-NH-NH2,
、NH2-NH-NH-NH2,
故答案为:2;
(3)酸性为H2CO3>HCO3->H2O,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:OH->CO32->HCO3-,OH-结合质子(H+)的能力比NH3强、其理由可以表示为:NH4++OH-═NH3+H2O.得到CO32-、OH-结合质子的能力的原因是HCO3-+OH-=CO32-+H2O,
故答案为:OH->CO32-,HCO3-+OH-=CO32-+H2O;
(4)用N2H4与NO2可组合制成燃料电池,产物中无污染物,即为氮气和水,二氧化氮中氮元素化合价降低,在原电池的正极上时二氧化氮发生得电子的还原反应:4H2O+2NO2+8e-=N2+8OH-,
故答案为:4H2O+2NO2+8e-=N2+8OH-;
(5)每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ,热化学方程式为:CaCO3(s)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol,
故答案为:CaCO3(s)+2HCl(aq)=CaCl2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol.
点评 本题涉及热化学、电化学、弱电解质的电离等综合知识的考查,注意知识的归纳和整理是关键,难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能大小:S>P>Si | |
| B. | 电负性顺序:C<N<O<F | |
| C. | 晶格能是气态离子形成1摩离子晶体释放的能量,晶格能越大,形成的离子晶体越稳定 | |
| D. | 由于N2和O22+互为等电子体,所以可以推断O22+的电子式为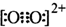 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ①④⑤ | C. | ①④⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时,化学反应速率无论用哪种物质表示,其数值是相等的 | |
| B. | 其他条件不变,降低温度,反应速率减慢 | |
| C. | 其他条件不变时,增大压强,化学反应速率一定加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作水果的催熟剂 | B. | SO2可用于杀菌消毒 | ||
| C. | 2H和3H可用于制造氢弹 | D. | 裂化汽油可用作萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
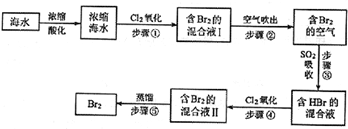
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com