
 .
.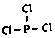 .白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.
.白磷固体和W2气体反应,生成1mol液态丙时,能量变化如图2所示,写出该反应的热化学方程式$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol.已知1mol白磷固体和W2气体反应,生成固态丁时,放热bkJ,则1mol固态丁转化为液态丙时的△H=($\frac{1}{4}$b-a)KJ/mol.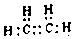 .
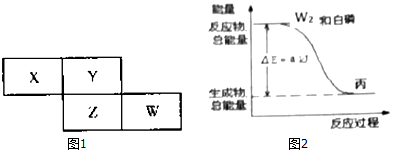
.分析 根据X、Y、Z、W四种短周期元素在周期表中的位置关系可知,X、Y在第二周期,Z、W在第三周期.
I.由于Y在第二周期,且Y元素原子的最外层电子数是电子层数的3倍,故Y的核外电子排布为2,6,故为O元素,则X为N元素,Z为S元素,W为Cl元素.
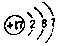
(1)W为氯元素,核内有17个质子,核外有17个电子;
(2)元素的非金属性越强,则最高价氧化物的水化物的酸性越强;
(3)白磷(P4)在氯气体中燃烧可生成液态丙分子即PCl3,也可生成固态丁分子即PCl5,据此写出PCl3的结构式;白磷固体和氯气反应,生成1molPCl3时,根据图示可知,反应放热aKJ,据此写出热化学方程式;而已知1mol白磷固体和氯气反应,生成固态丁PCl5时,放热bkJ,写出热化学方程式并根据盖斯定律来计算1mol固态丁转化为液态丙时的△H;
II.设Y的核外电子数为y个,则Z为(y+8),根据若Y和Z的核外电子数之和为20,可解得y=6,即Y为C元素,则Z为Si元素,W为P元素.
(1)相对分子质量为28的Y的氢化物为SiH4,为共价化合物,据此写出电子式;
(2)W的一种单质溶于足量浓硝酸,反应后变为+5价,而由于反应过程转移电子物质的量是该单质的20倍.故此单质为P4,据此写出化学方程式.
解答 解:根据X、Y、Z、W四种短周期元素在周期表中的位置关系可知,X、Y在第二周期,Z、W在第三周期.
I.由于Y在第二周期,且Y元素原子的最外层电子数是电子层数的3倍,故Y的核外电子排布为2,6,故为O元素,则X为N元素,Z为S元素,W为Cl元素.
(1)W为氯元素,核内有17个质子,核外有17个电子,故其结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素的非金属性越强,则最高价氧化物的水化物的酸性越强,而由于非金属性Cl强于S,故酸性HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)白磷(P4)在氯气体中燃烧可生成液态丙分子即PCl3,也可生成固态丁分子即PCl5,PCl3是共价化合物,结构式为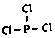 ;
;
白磷固体和氯气反应,生成1molPCl3时,根据图示可知,反应放热aKJ,故热化学方程式为$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol ①;
而已知1mol白磷固体和氯气反应,生成固态丁PCl5时,放热bkJ,即热化学方程式为:$\frac{1}{4}$P4(s)+$\frac{5}{2}$Cl2(g)=PCl5(s)△H=-$\frac{1}{4}$bkJ/mol ②.
根据盖斯定律,将(①-②)可得:PCl5(s)=Cl2(g)+PCl3(l)△H=($\frac{1}{4}$b-a)KJ/mol.
故答案为: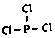 ;$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol;($\frac{1}{4}$b-a)KJ/mol;
;$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-akJ/mol;($\frac{1}{4}$b-a)KJ/mol;
II.设Y的核外电子数为y个,则Z为(y+8),根据若Y和Z的核外电子数之和为20,有:y+y+8=20,可解得y=6,即Y为C元素,则Z为Si元素,W为P元素.
(1)相对分子质量为28的Y的氢化物为C2H4,即为乙烯,为共价化合物,故电子式为: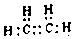 ,故答案为:
,故答案为: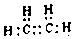 ;
;
(2)W的一种单质溶于足量浓硝酸,反应后变为+5价,即生成H3PO4,而硝酸被还原为NO2,而由于反应过程中转移电子物质的量是该单质的20倍.故此单质为P4,故化学方程式为:P4+20HNO3(浓)=20NO2↑+4H3PO4+4H2O,故答案为:P4+20HNO3(浓)=20NO2↑+4H3PO4+4H2O;
点评 本题考查了元素的推导和结构式、电子式的书写以及化学方程式、热化学方程式的书写,难度不大,应注意的是盖斯定律的应用.


科目:高中化学 来源: 题型:选择题

| A. | +2(a-b-c) kJ•mol-1 | B. | +2(b-a) kJ•mol-1 | ||
| C. | +(b+c-a) kJ•mol-1 | D. | +(a+b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:
W、X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;W是形成有机物种类最多的元素;R2+的3d轨道中有9个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4(CuSO4):加足量铁粉后,过滤 | |
| B. | CO(CO2):用NaOH溶液洗气后干燥 | |
| C. | MnO2(KCl):加水溶解后,过滤、洗涤、烘干 | |
| D. | N2(O2):通过灼热的氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热) | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H(中和热) | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H (燃烧热) | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度、压强下,气体体积由其物质的量的多少决定 | |
| B. | 两种物质的物质的量相同,则它们在标准状况下的体积相同 | |
| C. | 同温同压下,气体的密度与气体的相对分子质量成正比 | |
| D. | 同温同体积时,气体物质的物质的量越大,则压强越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com