
| A. | 分子数目之比为5:4 | B. | 氧原子数目之比为5:6 | ||
| C. | 硫原子数目之比为4:5 | D. | 摩尔质量之比为4:5 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算.
解答 解:假设质量都为1g,则n(SO2)=$\frac{1}{64}$mol,n(SO3)=$\frac{1}{80}$mol,
A.分子数之比等于物质的量之比为$\frac{1}{64}$mol:$\frac{1}{80}$mol=5:4,故A正确;
B.氧原子数目之比等于氧原子的物质的量之比,为$\frac{1}{64}$mol×2:$\frac{1}{80}$mol=5:6,故B正确;
C.硫原子数目之比等于物质的量之比为5:4,故C错误;
D.摩尔质量之比为64:80=4:5,故D正确.
故选C.
点评 本题考查物质的量的计算,为高频考点,侧重分析、计算能力的考查,较为基础,注意把握相关计算公式的运用以及物质的构成特点,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 需要持续加热才能发生的反应一定是吸热反应 | |
| B. | MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 | |
| C. | 分别稀释10mLpH=1的盐酸和醋酸至100mL,后者pH变化大,说明醋酸是弱酸 | |
| D. | 向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2a}{V}$ | B. | $\frac{2b-5a}{V}$ | C. | $\frac{10b-5a}{V}$ | D. | $\frac{5a-10b}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量是4g | B. | 标准状况下的体积约为33.6L | ||
| C. | 电子数是3mol | D. | 分子数是9.03×1023 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-Cl- Na+ H+ | B. | K+ Na+ SO42- Ba2+ | ||
| C. | Cl- Na+ Ag+ NO3- | D. | CO32- SO42- Cl- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
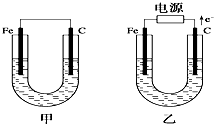 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 | B. | 0.04mol/(L.s) | C. | 0.08mol(L.s) | D. | 0.04mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com