
 CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。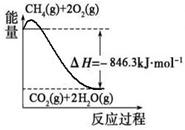
 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0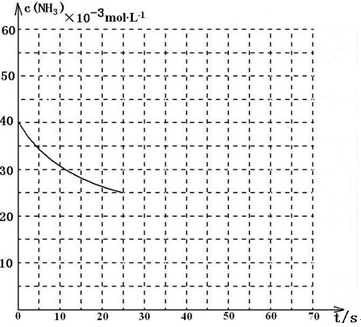
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
 CO(g)+3H2(g) △H=+161.1 kJ·mol-1(2分) (2)B(2分)
CO(g)+3H2(g) △H=+161.1 kJ·mol-1(2分) (2)B(2分) (说明:曲线的转折点在横坐标40之前,纵坐标必需在20的线上)(3分,画出纵坐标为20的直线给2分、画出曲线转折点在横坐标40之前给1分)
(说明:曲线的转折点在横坐标40之前,纵坐标必需在20的线上)(3分,画出纵坐标为20的直线给2分、画出曲线转折点在横坐标40之前给1分) 2H2O(g)+CO2(g) △H=-846.3kJ/mol,②、CO(g)+
2H2O(g)+CO2(g) △H=-846.3kJ/mol,②、CO(g)+ O2(g)
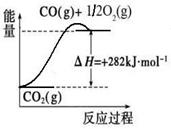
O2(g) CO2(g) △H=+282kJ/mol,③、H2(g)+
CO2(g) △H=+282kJ/mol,③、H2(g)+ O2(g)
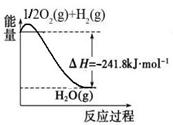
O2(g) H2O(g) △H=-241.8kJ/mol,则根据盖斯定律可知①-②-③×3即得到热化学方程式CH4(g)+H2O(g)
H2O(g) △H=-241.8kJ/mol,则根据盖斯定律可知①-②-③×3即得到热化学方程式CH4(g)+H2O(g) CO(g)+3H2(g),所以该反应的反应热△H=-846.3kJ/mol+282kJ/mol+241.8kJ/mol×3=+161.1 kJ/mol。
CO(g)+3H2(g),所以该反应的反应热△H=-846.3kJ/mol+282kJ/mol+241.8kJ/mol×3=+161.1 kJ/mol。 CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g) =
= =2500。
=2500。

科目:高中化学 来源:不详 题型:单选题
| A.金属键 | B.离子键 |
| C.共价键 | D.既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,所以需要加热才能使反应进行 |
| C.该反应的能量变化与化学键变化无关 |
| D.X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H4=(△H1+△H2-3△H3) | B.△H4=(3△H3-△H1-△H2) |
| C.△H4=(△H1+△H2-3△H3) | D.△H4=(△H1-△H2-3△H3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1,3-丁二烯和2-丁炔稳定性的相对大小 |
| B.1,3-丁二烯和2-丁炔分子储存能量的相对高低 |
| C.1,3-丁二烯和2-丁炔相互转化的热效应 |
| D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-1367.0 kJ·mol-1(燃烧热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热) |
| C.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
| D.S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| 1 | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com