
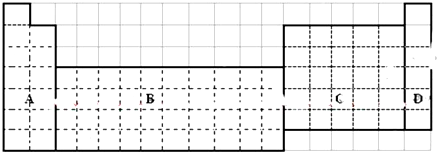
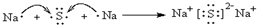 .
. 分析 (1)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素;
(2)过渡元素均为金属元素;
(3)第六周期含有32种元素,含有元素最多;第ⅢB族含有镧系元素、锕系元素;
(4)通常状况呈液态的非金属单质是溴,地壳中含量最多的非金属元素是氧元素;
(5)金属性越强,与水反应越剧烈;非金属性越强,元素的气态氢化物越稳定,元素的最高价氧化物的酸性越强;“原子半径最大的金属元素与质子数为16的元素形成的化合物”的化合物为Na2S,属于离子化合物.
解答 解:(1)第一周期没有金属,其它各周期元素中电子层数≤最外层电子数为金属元素,画出金属和非金属的分界线为: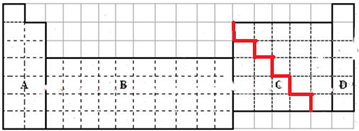 ,
,
故答案为: ;
;
(2)s区含有H元素,p区含有金属元素与非金属元素,过渡元素均为金属元素,为图中B区域,
故答案为:b;
(3)第六周期含有32种元素,含有元素最多;第ⅢB族含有镧系元素、锕系元素,是所含元素最多的族,
故答案为:第六周期;第ⅢB族;
(4)通常状况呈液态的非金属单质是溴,地壳中含量最多的非金属元素是氧元素,
故答案为:溴;氧;
(5)同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强.同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,短周期中Na的金属性最强,与水反应最剧烈;非金属性越强,元素的气态氢化物越稳定,元素的最高价氧化物的酸性越强,F元素非金属性最强,故HF最稳定,F元素没有最高价含氧酸,最高价含氧酸最强为HClO4,“原子半径最大的金属元素与质子数为16的元素形成的化合物”的化合物为Na2S,属于离子化合物,用电子式表示其形成过程为: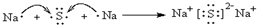 ,
,
故答案为:Na;HF;HClO4;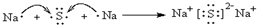 .
.
点评 本题考查元素周期表的结构和元素周期律的应用,熟练掌握元素周期表结构,理解元素周期律,掌握用电子式表示化学键或物质的形成过程.


科目:高中化学 来源: 题型:多选题
| A. | 酸性:H2SiO3<H2CO3 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:SiH4>PH3 | D. | 原子半径:N<C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
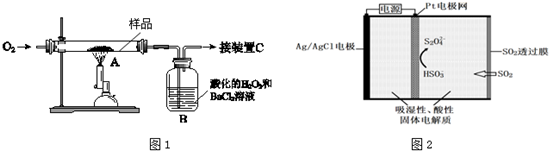
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 废FeCl3蚀刻液中加入少量铁粉、振荡 | 得到澄清溶液 | 蚀刻液中一定不含Cu2+ |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2,充分振荡,静置 | 有机相呈现橙色 | 氧化性:Cl2>Br2 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
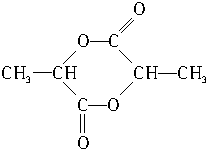 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氢气完全加成后的产物的一氯代物有5种 | |
| B. | 分子式为C4H9Br的卤代烃 (不考虑立体异构)有4种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸[CH3CH(NH2)COOH]脱水缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作正确 | |
| C. | 滴定前无气泡,滴定终了有气泡 | |
| D. | 配制标准溶液的Na0H中混有Na20杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com