
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
分析 【实验1】:(1)研究温度对化学反应速率的影响,应保证浓度相同、都不使用催化剂;
(2)实验Ⅰ和Ⅲ,硫酸的浓度不同,加入少量蒸馏水,让溶液的总体积相同;
【实验2】:(1)考虑锰离子有催化作用;
(2)要想验证锰离子的催化作用,再加入硫酸锰即可.
解答 解:【实验1】:(1)研究温度对化学反应速率的影响,应保证应保证浓度相同、都不使用催化剂,则选实验Ⅰ、Ⅱ,
故答案为:Ⅰ;Ⅱ;
(3)实验Ⅰ和Ⅲ,硫酸的浓度不同,可研究浓度对反应速率的影响,加2mL蒸馏水确保两实验中总体积相等都为16mL,让实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同,
故答案为:c(H+)(或硫酸溶液的浓度);确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同;
【实验2】:(1)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,
故答案为:催化剂;
(2)要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,
故选D.
点评 本题考查氧化还原反应及影响反应速率的因素,注意控制变量法研究影响因素,把握表格中的数据分析及应用,题目难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
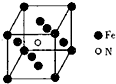 氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.
氮、硫、氯、钠、铝、铁及其化合物是研究基本概念和基本理论的重要载体.| 性质 | 第一电离能 | 熔点 | 半径 | 键能 |
| 对象 | S<Cl | Na<Al | N3->Al3+ | N=N<N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/L | B. | 1.4mol/L | C. | 1.7mol/L | D. | 1.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
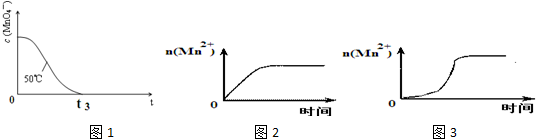
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 /℃ | 再向试管中加入少量固体 | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | ||||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | MnSO4 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的电子式: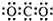 | |
| B. | 氯离子的结构示意图: | |
| C. | NaH与重水反应的化学方程式:NaH+D2=NaOH+D2 | |
| D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都含有 92个中子 | B. | 235U原子核外有143个电子 | ||
| C. | 它们互为同位素 | D. | 它们是同种核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com