
 碳及其化合物是一类种类繁多的大家族.
碳及其化合物是一类种类繁多的大家族.| 5 |
| 2 |
| ② |
| 2 |
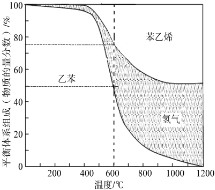
| 参加反应的乙苯 |
| 总的乙苯 |
| c(H2).c(苯乙烯) |
| c(乙苯) |
| 5 |
| 2 |
| ② |
| 2 |
| 5△H1-△H2 |
| 2 |
| 5△H1-△H2 |
| 2 |
| xmol |
| (a-x+2x)mol |
| 1 |
| 3 |
| 1 |
| 3 |
| 2a |
| 3 |
| 1 |
| 3 |
| 2a |
| 3V |
| a |
| 3V |
| c(H2).c(苯乙烯) |
| c(乙苯) |
| ||||
|
| a |
| 6V |
| a |
| 6V |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、在标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| B、1mol Cl2参加反应转移的电子数不一定为2NA |
| C、78g Na2O2固体中含有NA个阴离子 |
| D、足量的MnO2与500ml浓盐酸充分反应,产生了NA个Cl2分子,则盐酸的浓度一定大于8 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | K |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 为原料合成重要的化工产品
为原料合成重要的化工产品 的路线流程图(无机试剂任选)合成路线流程图示例如图2.
的路线流程图(无机试剂任选)合成路线流程图示例如图2.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用焰色反应鉴别氯化钠固体和氢氧化钠固体 |
| B、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
| C、用AgNO3溶液鉴别NaCl溶液和Na2SO4溶液 |
| D、用萃取法鉴别溴水和碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含大量Al3+的溶液中:NH4+、Na+、HCO3-、SO42- |
| B、能使甲基橙试液变红的溶液中:Na+、K+、MnO4-、NO3- |
| C、在水电离出的c(H+)=10-13mol?L-1 的溶液中:NH4+、[Al(OH)4]-、SO42-、NO3- |
| D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com