
| A. | 热稳定性:HF>H2O>NH3>CH4 | |
| B. | 离子半径:S2->K+>Na+>Al3+ | |
| C. | 碱性:Mg(OH)2<KOH<CsOH | |
| D. | 给出质子的能力:H3PO4<H2SO4<HClO |
分析 A.非金属性越强,氢化物稳定性越强,同一周期中原子序数越大,非金属性越强;
B.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小;
C.金属性越强,最高价氧化物对应水合物的碱性越强;
D.酸性越强,给出质子的能力越强.
解答 解:A.同一周期中原子序数越大,非金属性越强,则非金属性:F>O>N>C,非金属性越强,对应氢化物的稳定性越强,则氢化物的热稳定性:HF>H2O>NH3>CH4,故A正确;
B.Na+、Al3+含有2个电子层,S2-、K+含有3个电子层,则Na+、Al3+的离子半径小于S2-、K+的,电子层相同时,核电荷数越大,离子半径越小,则离子半径大小为:S2->K+>Na+>Al3+,故B正确;
C.金属性Mg<K<Cs,则最高价氧化物对应水合物的碱性:Mg(OH)2<KOH<CsOH,故C正确;
D.酸性强弱为:HClO<H3PO4<H2SO4,酸性越强,给出质子的能力越强,则给出质子的能力强弱为:HClO<H3PO4<H2SO4,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgI>AgCl>Ag2S | D. | AgCl>AgI>Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO | B. | O2 | C. | NaNO3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
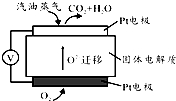 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、Y、Z 的电负性大小顺序一定是Z>Y>W | |
| B. | Z 的氢化物分之间存在氢键 | |
| C. | Y、Z 形成的分子的中心原子可能采用sp3杂化 | |
| D. | WY2分子中σ键与π键的数目之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
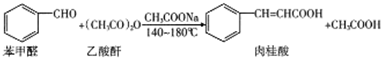
| 名称 | 分子量 | 相对密度 | 熔点 | 沸点 | 溶解度 |
| 苯甲醛 | 106 | 1.04 | -26 | 179.62 | 微溶于水,可混溶于乙醇、乙醚、苯 |
| 乙酸酐 | 102 | 1.080 | -73.1 | 138.6 | 溶于乙醚,易水解形成乙酸. |
| 肉桂酸 | 148 | 1.247 | 135 | 300 | 微溶于水,可以溶于苯、丙酮、乙醚、乙醇等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (2)(4) | C. | (1)(2)(4)(6) | D. | (2)(3)(4)(5) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com