


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源:不详 题型:单选题
| A.SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构 |
| B.化学反应中能量变化的大小与反应物的质量多少无关。 |
| C.经实验测得邻-二溴苯仅一种结构,说明苯环结构中,不存在单双键交替结构 |
| D.需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.联氨(N2H4)结构与C2H4相似,存在N=N双键 | |
| B.一分子联氨中含有的电子对数目为5 | C.联氨中的N原子的杂化类型为sp3杂化 |
| D.联氨能与HCl发生化合反应生成N2H6Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
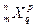 中,m、n、p、q表示某元素的四个角码。若x1与x2的q均为1,m、p对应相等,n不相等,则x1、x2表示的可能是( )
中,m、n、p、q表示某元素的四个角码。若x1与x2的q均为1,m、p对应相等,n不相等,则x1、x2表示的可能是( )| A.不同的原子 |
| B.不同的元素 |
| C.同种元素的不同原子形成的离子 |
| D.不同元素的离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | 100 | -87.7 | 19.54 | -84.9 |
| 最高化合价 | +6 | +5 | +5 | +7 | ||
| 最低化合价 | -2 | -3 | -2 | -3 | -1 | -1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 周期族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4 | B.H2CO3 | C.HNO3 | D.H2SiO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com