
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.16g/ml×36.5% |
| 36.5g/mol |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 |
| B、检验酒精中的少量水:向酒精中加入足量生石灰 |
| C、制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、除去乙炔中杂质气体:将实验室制得的乙炔气体通入硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L SO3所含分子数为0.5 NA |
| B、1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C、64g二氧化硫含有原子数为3NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
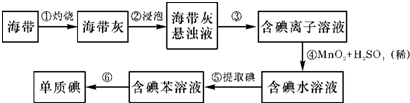
查看答案和解析>>
科目:高中化学 来源: 题型:
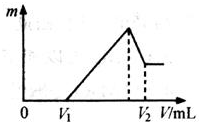 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
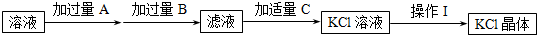
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com