
研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3 -的方程式: 。
-的方程式: 。
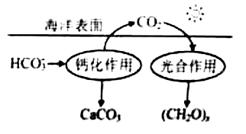
(2)在海洋循环中,通过右图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
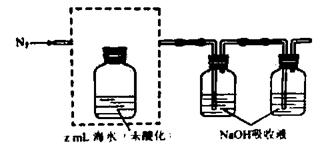
②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度=  mol/L。
mol/L。
(4)利用右图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
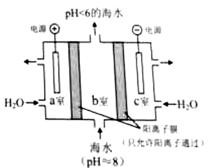
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
下列各组中的每种物质内既有离子键又有共价键的一组是 ( )
A.NaOH、K2SO4、(NH4)2SO4 B.HCl、Al2O3、MgCl2
C.Na2O2、NH4Cl、Na2SO4 D.MgO、Na2SO4、NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
由2氯丙烷制取少量的1,2丙二醇(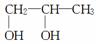 )时,需要经过下列哪几步反应( )
)时,需要经过下列哪几步反应( )
A.加成→消去→取代 B.消去→加成→水解
C.取代→消去→加成 D.消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
用O2将HCl转化为Cl2,可提高效益,减少污染,
(1)传统上该转化通过如右图所示的催化剂循环实现,

其中,反应①为:2HCl(g) + CuO(s) 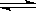 H2O(g)+CuCl2(g) △H1
H2O(g)+CuCl2(g) △H1
反应②生成1molCl2 (g)的反应热为△H2,则总反应的热化学方程式
(g)的反应热为△H2,则总反应的热化学方程式
为 , (反应热用△H1和△H2表示)。
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的ɑHCl—T曲线如图12,
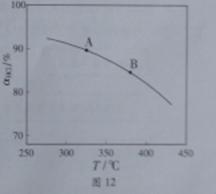
则总反应的△H 0 ,(填“>”、“﹦”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是 。
②在上述实验中若压缩体积使压强增大,画出相应ɑHCl—T曲线的示意图,并简要说明理由: 。
③下列措施中有利于提高ɑHCl的有 。
 A、增大n(HCl) B、增大n(O2)
A、增大n(HCl) B、增大n(O2)
C、 使用更好的催化剂 D、移去H2O
使用更好的催化剂 D、移去H2O
(3)一定条件下测得反应过程中n(Cl 2)的数据如下:
2)的数据如下:
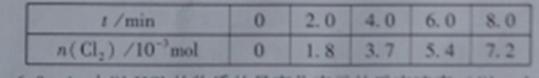
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol·min-1为单位,写出计算过程)。
(4)Cl2用途 广泛,写出用Cl2制备漂白粉的化学方程式。
广泛,写出用Cl2制备漂白粉的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成导电高分子材料PPV的反应:
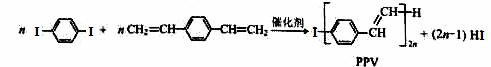
下列说法中正确的是
A.合成PPV的反应为加聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
C.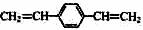 和苯乙烯互为同系物
和苯乙烯互为同系物
D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关NaClO和NaCl混合溶液的叙述正确的是:
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:
2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组将纯净的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组突出了如下假设:
假设 一:溶液中的NO3-
一:溶液中的NO3-
假设二:溶液中溶解的O2
(1) 验证假设
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图
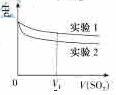
实验1中溶液pH变小的原因是____;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
(2) 验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
(3) 若假设二成立,请预测:在相同条件下,分别通入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反映后两溶液的pH前者_______(填大于或小于)后者,理由是
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应所画图象错误的是( )
| A | B | C | D |
| 将二氧化硫通入 到一定量氯水中 | 将氨水滴入到一定 量氯化铝溶液中 | 将铜粉加入到 一定量浓硝酸中 | 将铁粉加入到一 定量氯化铁溶液中 |
|
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com