
����Ŀ�����ⶨ�������Ȼ��Ƶ�С�մ��̬��Ʒ��NaHCO3�����������ɲ����������ַ�����
����һ��
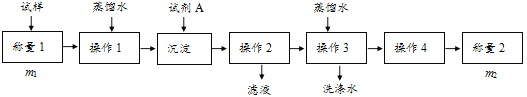
��������
�����ģ���ʹ�û�ѧ�Լ���ʹ��ʵ���ҳ���������
��1������һ�������������Լ�A___����дA�Ļ�ѧʽ���ɽ�HCO3-����ת��Ϊ���������ء�����1��2��3��4�������������ܽ⡢___��ϴ�Ӻ��
��2�����������ڲ���1�����õ��IJ��������У������ձ����������⣬����Ҫ���õ�����___���ڲ���2��Ӧѡ�����ָʾ����
��3���ڷ������м������Ʒ��NaHCO3����������Ϊ___[������ͼ�е�����m��V��HCl����д�йصı���ʽ]��
��4���ڷ������У��������õ�ʵ��װ�ã����˳������������⣬����ⶨ��ʵ��������___��
��5����ϸ�����������е�ʵ��װ�ã����ɴ˲�õ�����������ʵ���������п���ƫ��Ҳ�п���ƫ�ͣ�ƫ�ߵ�ԭ�������___��ƫ�͵�ԭ�������___�������ּ�������
��6�������ĵ�ʵ��ԭ���ǣ�___���û�ѧ����ʽ��ʾ����
���𰸡�Ca��OH��2��Ba��OH��2 ���� 100mL����ƿ ![]() ��100% ��ʯ����ʵ��ǰ������� ��ʯ�ҿ��ܻ������տ����е�ˮ����CO2���� Բ����ƿ�ڻ����沿��CO2���� 2NaHCO3
��100% ��ʯ����ʵ��ǰ������� ��ʯ�ҿ��ܻ������տ����е�ˮ����CO2���� Բ����ƿ�ڻ����沿��CO2���� 2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
��������
��1����HCO3-��Ӧ�����������Լ���Ca��OH��2�� Ba��OH��2����HCO3-��Ӧ����������Ӧ���еIJ���Ϊ���ˡ�ϴ�ӡ����
��2����̬��Ʒ��ˮ�ܽ��100mL��Һ�����Ի���100mL������ƿ��
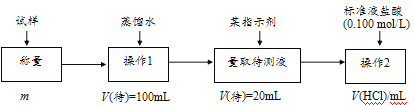
��3������������̼�����ư�1��1��Ӧ������������������ʵ�����Ϊ̼�����Ƶ����ʵ���������100mL��ȡ20mL���еζ�������ԭҺ�Ǵ���Һ��5�������ݹ�ϵʽ�������NaHCO3������������
��4���������Ϸ��������ò���������̼������������̼�����Ƶ�������������Ҫ����װ�м�ʯ�ҵĸ������ʵ��ǰ���������
��5����Ϊ��ʯ��ֱ��������Ӵ�������ƫ�ߵ�ԭ���Ǽ�ʯ�һ������տ����еĶ�����̼��ˮʹ����������Ϊװ���л����в����Ķ�����̼������ƫ�͵�ԭ����װ���л��в����Ķ�����̼δ�����գ�
��6������̼�����ƹ������ȷֽⷴӦǰ������������̼�����Ƶ�����������
��1������һ����HCO3-��Ӧ�����������Լ���Ca��OH��2�� Ba��OH��2�������Լ�AΪCa��OH��2�� Ba��OH��2����HCO3-��Ӧ����������Ӧ���еIJ���Ϊ���ˡ�ϴ�ӡ�����ʴ�Ϊ��Ca��OH��2 ��Ba��OH��2�����ˣ�
��2���������й�̬��Ʒ��ˮ�ܽ��100mL��Һ�����Ի���100mL������ƿ���ʴ�Ϊ��100mL����ƿ��
��3������������̼�����ư�1��1��Ӧ������������������ʵ�����Ϊ̼�����Ƶ����ʵ���������100mL��ȡ20mL���еζ�������ԭҺ�Ǵ���Һ��5����������Ʒ��NaHCO3������ΪV��HCl����10-3��0.100��5��84=0.042V��HCl��g����������Ϊ![]() ��100%���ʴ�Ϊ��
��100%���ʴ�Ϊ��![]() ��100%��
��100%��
��4���������Ϸ��������ò���������̼������������̼�����Ƶ�������������Ҫ����װ�м�ʯ�ҵĸ������ʵ��ǰ����������ʴ�Ϊ����ʯ����ʵ��ǰ���������
��5����Ϊ��ʯ��ֱ��������Ӵ�������ƫ�ߵ�ԭ���Ǽ�ʯ�һ������տ����еĶ�����̼��ˮʹ����������Ϊװ���л����в����Ķ�����̼������ƫ�͵�ԭ����װ���л��в����Ķ�����̼δ�����գ��ʴ�Ϊ����ʯ�ҿ��ܻ������տ����е�ˮ����CO2���壻Բ����ƿ�ڻ����沿��CO2���壻
��6������������ѧ�Լ�����ֻ����̼�����Ƶ����ȷֽ⣬���ù��巴Ӧǰ������������̼�����Ƶ�������������ѧ����ʽ��2NaHCO3 ![]() Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3
Na2CO3+H2O+CO2�����ʴ�Ϊ��2NaHCO3 ![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ��ǣ� ��
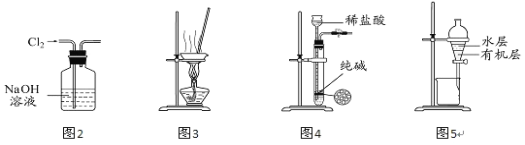
A.��ͼ2��ʾװ�ó�ȥCl2�к��е�����HCl
B.��ͼ3 ��ʾװ������NH4Cl������Һ�Ʊ�NH4Cl����
C.��ͼ4 ��ʾװ����ȡ����������CO2����
D.��ͼ5 ��ʾװ�÷���CCl4��ȡ��ˮ���ѷֲ���л����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��1����������ҺA��B��1mL���ֱ��ˮϡ�͵�1000mL����pH����Һ���(V)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����( )

A.��a��4����A��ǿ�ᣬB������
B.ϡ�ͺ�A����Һ�����Ա�B����Һ��
C.ϡ��ǰ��������Һ��Ũ�ȣ�c(A)>c(B)
D.��1��a��4����A��B��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У�����ԭ���⣬ÿ��ԭ���������ﵽ8���ӽṹ�������ǵĽṹʽ������ǣ� ��
A.�����ӣ�O=O
B.S2Cl2��Cl-S-S-Cl
C.�����H-C![]() N
N
D.������COCl2����Cl-C-O-Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ǹ�ҵ���Ʊ�Na2S2O3�ķ���֮һ����Ӧԭ��Ϊ��2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2���÷�Ӧ��>0��ij�о�С����ʵ��������Ʊ�Na2S2O3��5H2O�������¡�

��1������װ����ͼ��ʾ��

��װ��B�������Ǽ���װ����SO2������Ч�ʣ�B���Լ���________������SO2����Ч�ʵ͵�ʵ��������B����Һ________________��
��Ϊ��ʹSO2������������ȫ���ڲ��ı�A����ҺŨ�ȡ�����������£����˼�ʱ���跴Ӧ���⣬���ɲ�ȡ�ĺ�����ʩ��_______��_______����д��������
��2�����豾ʵ�����õ�Na2CO3������NaCl��NaOH�����ʵ�鷽�����м��顣������ʱCaCO3������Һ��pH=12��, �����Լ���������ϡ���ᡢAgNO3��Һ��CaCl2��Һ��Ca(NO3)2��Һ����̪��Һ������ˮ��pH�ơ��ձ����Թܡ��ιܡ�
��� | ʵ����� | Ԥ������ | ���� |
�� | ȡ������Ʒ���Թ��У�������������ˮ��������ܽ⣬_________�� | �а�ɫ�������� | ��Ʒ��NaCl |
�� | ��ȡ������Ʒ���ձ��У�������������ˮ��������ܽ⣬_________�� | �а�ɫ�������ɣ��ϲ���ҺpH>10.2 | ��Ʒ��NaOH |
��3��Na2S2O3��Һ�Ƕ���ʵ���еij����Լ����ⶨ��Ũ�ȵĹ������£�
��һ����ȷ��ȡag KIO3����Է���������214�����������Һ��
�ڶ������������KI�����H2SO4��Һ���μ�ָʾ����
����������Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ��Һ�����ΪvmL ��c(Na2S2O3��Һ)��_______mol��L-1����ֻ�г���ʽ���������㣩
��֪��IO3-��I-��6H+=3I2+3H2O ��2S2O32-��I2=S4O62-��2I- ijͬѧ��һ���͵ڶ����IJ������ܹ淶������������̫����������õ�Na2S2O3��Ũ�ȿ���_____�������Ӱ�족����ƫ�͡���ƫ�ߡ�) ��ԭ����________�������ӷ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����е��³������ݺύ���Ĺܵ��������·����Щ�����ϻ����е�������������죬���е���й©�볱ʪ�������У���������ܵ��������γɻ�·ʱ���ͻ�������ߵĸ�ʴ��ԭ������ͼ��ʾ���������й�˵������ȷ����
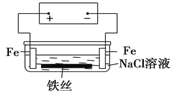
A.ԭ��ͼ������Ϊ�����������װ��
B.��Һ����˿����ʴʱ���������ɫ�����������������������ɫ����������Ϊ����ɫ
C.��Һ����˿��˵缫��ӦʽΪ��Fe-2e-=Fe2+
D.���¹��߱���ʴ�������֣�ά��Ҳ���㣬��Ӧ�����ڵ��µĽ����ܵ�����Ϳ��ԵĤ(�������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����нṹͼ��������ǰ������Ԫ�ص�ԭ��ʵ��ԭ��ʵ��ԭ�ӳ�ȥ�������Ӻ�ʣ��IJ��֣���С�� �����δ�����γɹ��ۼ����������ӣ����ߴ����ۼ���ʾ��
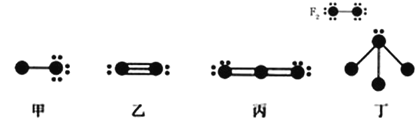
���ݸ�ͼ��ʾ�Ľṹ�ص㣬�����й�������ȷ����
A.�����ס��ҡ��������ṹͼ�й����� 6 ��Ԫ��
B.�ס��ҡ���Ϊ�Ǽ��Է��ӣ���Ϊ���Է���
C.���붡���Է������Ϸ�Ӧ���������к�����λ��
D.�������� NH3��Ҳ������ NF3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������I�̶��������������������ƶ���M��N���������о�������Ӧ��A(g)+2B(g)![]() xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )
xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )

A. ��x=3���ﵽƽ���A�����������ϵΪ����(M)����(N)
B. ��x��3���ﵽƽ���B��ת���ʹ�ϵΪ����(M)����(N)
C. ��x��3��C��ƽ��Ũ�ȹ�ϵΪ��c(M)��c(N)
D. x����Ϊ��ֵ����ʼʱ��N�����г�������ֵ��C��ƽ���N������A��Ũ�Ⱦ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����CO2�ŷ���һ����Ҫ���⡣CO2��������������ɵ�̼�л����Ҫ�����·�Ӧ��
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H1����49.6kJ/mol
��Ӧ��CH3OCH3(g)��H2O(g) 2CH3OH(g) ��H2����23.4kJ/mol
��Ӧ��2CO2(g)��6H2(g) CH3OCH3(g)��3H2O(g) ��H3
(1)��H3��__________kJ/mol��
(2)���º��������£����ܱ�������ͨ������ʵ�����CO2��H2��������Ӧ������������˵����Ӧ��ﵽƽ��״̬����_____________(�����).
A.��Ӧ��ϵ��ѹǿ���ֲ���
B.�����ڵĻ��������ܶȱ��ֲ���
C.ˮ�����ж���2NA��H��O����ͬʱ������ж���3NA��H��H��
D.CH3OH��H2O��Ũ��֮�ȱ��ֲ���
(3)��Ӧ����ij�¶��µ�ƽ�ⳣ��Ϊ0.25�����¶��£����ܱ������м�������ʵ�����CH3OCH3(g)��H2O(g)����Ӧ��ijʱ�̲�ø����Ũ�����£�

��ʱ��v��_________v�� (����>������<����������)������Ӧ�ﵽƽ��ʱ�����������CH3OH�������(CH3OH)%��_________%��
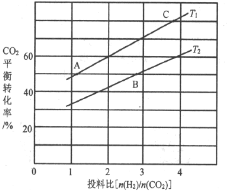
(4)��ӦIII�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��T1�¶��£���6 mol CO2��12 mol H2����2L���ܱ������У�5 min��Ӧ�ﵽƽ��״̬����0��5min�ڵ�ƽ����Ӧ����v(CH3OCH3)=________��ƽ�ⳣ��K=_____������С�����һλ����KA��KB��KC����֮����ɴ�С��ϵΪ______��
(5)��ѹ�½�CO2��H2�������1��3��ϣ��ڲ�ͬ���������·�����Ӧ��ͷ�Ӧ������ͬ��ʱ�����CH3OH��ѡ���ԺͲ������¶ȵı仯����ͼ�����У�CH3OH��ѡ���ԣ�![]() ��100��
��100��
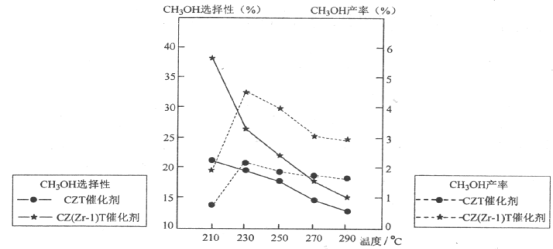
���¶ȸ���230��C��CH3OH�������¶����߶��½���ԭ����_______________������һ�����ɣ�
�������������ºϳɼ״��Ĺ�ҵ������___________________��
A.210��C B.230��C C.����CZT D.����CZ(Zr��1)T
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com