
分析 甲、乙两种常见胃药,甲是白色结晶状粉末,能溶于水,水溶液呈弱碱性,受热分解,遇酸及酸性药物则产生二氧化碳,胃酸过多患者服用后多见胃胀气,甚至有引起溃疡穿孔的危险,则甲为NaHCO3;
乙与胃酸的中和作用缓慢持久,凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+,可溶于稀酸或氢氧化钠溶液,则乙为Al(OH)3,据此解答.
解答 解:甲、乙两种常见胃药,甲是白色结晶状粉末,能溶于水,水溶液呈弱碱性,受热分解,遇酸及酸性药物则产生二氧化碳,胃酸过多患者服用后多见胃胀气,甚至有引起溃疡穿孔的危险,则甲为NaHCO3;
乙与胃酸的中和作用缓慢持久,凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+,可溶于稀酸或氢氧化钠溶液,则乙为Al(OH)3,
(1)甲中含有的主要化学成分是NaHCO3;乙中含有的主要化学成分是Al(OH)3,
故答案为:NaHCO3;Al(OH)3;
(2)胃酸主要成份为元素,碳酸氢钠与盐酸反应生成二氧化碳,引起胃胀气,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
(3)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素化合物推断、常用化学用语,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
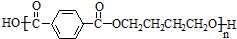
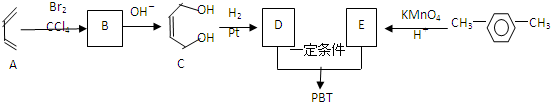
 互为同系物关系.
互为同系物关系.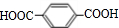 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$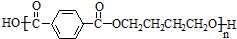 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
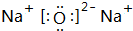 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com