
| A. | 反应物的转化率 | B. | 反应体系的压强 | ||
| C. | 正、逆反应的速率 | D. | 反应混合物的浓度 |
分析 分析条件的改变会导致哪些量的变化,是否引起速率变化,如果速率不变,平衡一定不移动.
如果速率改变,平衡不一定移动:
(1)改变程度相同[V(正)=V(逆)],平衡不移动;
(2)改变程度不相同[V(正)≠V(逆)],平衡移动.
解答 解:A、只有平衡移动才能改变反应物的转化率,所以反应物的转化率改变时,化学平衡一定发生了移动,故A正确;
B、如果反应前后气体总物质的量不变,则压强对平衡无影响,故B错误.
C、使用合适的催化剂,正、逆反应速率都改变,但平衡不移动,故C错误;
D、如果混合物中各组分的浓度变化而保持各组分的含量不变时,平衡不移动,故D错误;
故选A.
点评 本题考查了化学平衡的移动的判断,难度较大,注意
1、不要把V(正)增大与平衡向正反应方向移动等同起来,只有V(正)>V(逆)时,平衡向正反应方向移动.
2、不要把平衡向正反应方向移动与原料转化率的提高等同起来.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
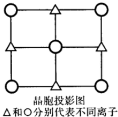 X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
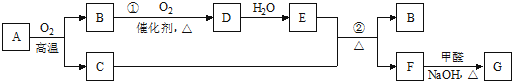
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
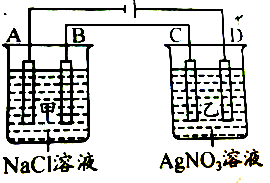 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )| A. | 2:2:4:1 | B. | 2:3:4:1 | C. | 1:4:2:2 | D. | 1:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
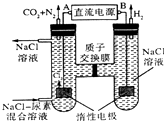
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极,左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取溴 | |
| B. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入NaOH溶液中振荡,静置,分液 | |
| C. | 乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 | |
| D. | 乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com