
| A. | 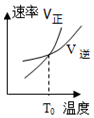 | B. | 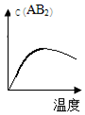 | C. | 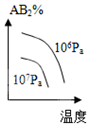 | D. | 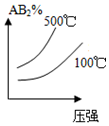 |
分析 该反应的正反应是一个反应前后气体体积减小的放热反应,升高温度平衡逆向移动,增大压强平衡正向移动,当改变条件时图象符合平衡移动原理时就正确,否则不正确,据此分析解答.
解答 解:A.T0时为平衡点,升高温度平衡逆向移动,则正反应速率大于逆反应速率,所以不符合勒夏特列原理,故A错误;
B.最高点时该反应达到平衡状态,升高温度平衡逆向移动,生成物浓度降低,符合勒夏特列原理,故B正确;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,产物浓度降低;该反应前后气体体积减小,增大压强平衡正向移动,生成物含量增大,不符合勒夏特列原理,故C错误;
D.增大压强平衡正向移动,生成物浓度升高;升高温度平衡逆向移动,生成物浓度降低,故D错误;
故选B.
点评 本题考查图象分析,为高频考点,明确外界条件对化学平衡移动影响及图象变化是解本题关键,侧重考查学生分析判断能力,会正确画出相应的图象,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:实验题

 ;该反应的类型为取代.
;该反应的类型为取代.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
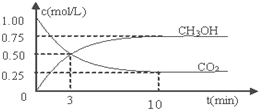
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
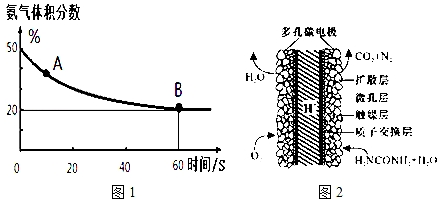
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
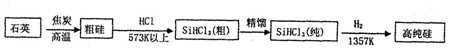
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W在元素周期表中位于第三周期第IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的常见离子化合物,其阳离子与阴离子个数比可能为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 原子数 | C. | 质子数 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
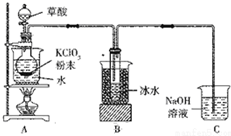 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com