
分析 由Y和Z两种元素可以形成4核42个电子的负一价阴离子,分情况讨论、计算得Y、Z分别是氯、氧元素;结合①得是K元素.X、Y的最高价氧化物的水化物分别是氢氧化钾、高氯酸,它们发生的反应是酸碱中和反应生成盐和水.
解答 解:(1)Y和Z两种元素形成的4核负一价阴离子有以下三种情况:(1)Y2Z2-、(2)YZ3-、(3)Y3Z-,由于该负一价阴离子有42个电子,电子数是偶数,可排除情况(1),
根据情况(2)、(3)讨论、计算.令Z的质子数为n,由知②,则Y的质子数为n+9,若情况(2):(n+9)+3n+1=42;解之得:n=8;则n+9=17.所以Z为O元素,Y为Cl元素.
若情况(3):3(n+9)+n+1=42;解之得:n=3.5(不合题意,舍去).
故Z为O元素,Y为Cl元素.X+和Y-是两种简单的一价离子,具有相同的电子层结构,X、Y两元素处于相邻的两周期,且X位于Y的下一周期,Y为Cl,Cl-核外有18个电子,
所以X+核外有18个电子,因此,X+核内质子数为18+1=19,故X为K元素,
故答案为:钾;氯;
(2)K元素最高价氧化物对应水化物为KOH,是强碱;Cl元素最高价氧化物对应水化物HClO4,是强酸,两者相互反应的离子方程式为OH-+H+═H2O,
故答案为:OH-+H+═H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握原子结构、电子排布知识推断元素为解答的关键,侧重分析与推断能力、应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
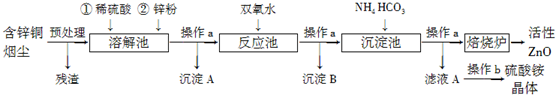
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
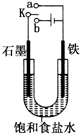 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O4的摩尔质量是64 g | |
| B. | O4与O2互为同位素 | |
| C. | O4与O3、O2都是氧元素的同分异构体 | |
| D. | 相同质量的O4与O3所含原子个数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
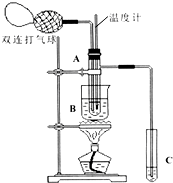 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
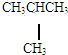
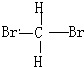 和
和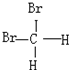 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com