
【题目】一定条件下,在体积固定的密闭容器中进行:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法错误的是( )
2NH3(g),下列有关说法错误的是( )
A.达平衡时单位时间内生成氢气的物质的量与生成氨气的物质的量相同
B.使用催化剂可以加快反应速率,缩短达平衡时间
C.为了提高氢气的转化率,可以适当补充氮气
D.达平衡时,密闭容器中的气体的总物质的量比起始时的总物质的量小
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,若![]() 轴表示流入正极的电子的物质的量,则y轴可以表示( )
轴表示流入正极的电子的物质的量,则y轴可以表示( )
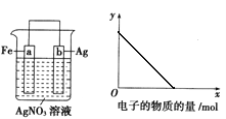
①c(Ag+) ②c(NO3-)③a棒的质量 ④b棒的质量 ⑤溶液的质量
A.①③ B.②④ C.①③⑤ D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研团队成功研究出高比能量、低成本的钠离子二次电池,其工作原理示意图如图。已知电池反应:Na1-xMnO2+NaxCn![]() NaMnO2+nC。下列说法正确的是( )
NaMnO2+nC。下列说法正确的是( )
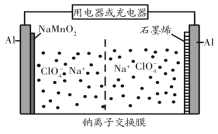
A.电池放电过程中,NaMnO2/Al上的电势低于石墨烯/Al上的电势
B.电池放电时,正极可发生反应Na1-xMnO2+xNa++xe-=NaMnO2
C.电池充电时,外接电源的负极连接NaMnO2/Al电极
D.电池充电时,Na+由NaMnO2/Al电极移向石墨烯/Al电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润的红色石蕊试纸变蓝的气体,A和 B是汽车尾气的主要成分,它们之间能发生如下反应:
①![]() ;
;
②![]()
![]() 白烟
白烟![]() ;
;
③![]()
(1)写出它们的化学式:A______,C______,D______,F______.
(2)写出![]() 反应的化学方程式,并按要求填空:_______________________________,这个反应______
反应的化学方程式,并按要求填空:_______________________________,这个反应______![]() 填“属于”或“不属于”
填“属于”或“不属于”![]() 氧化还原反应;
氧化还原反应;
(3)工业生产C的过程中有一步反应为F经催化氧化生成B和![]() ,写出该步反应的化学方程式:________________________________.
,写出该步反应的化学方程式:________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如图:
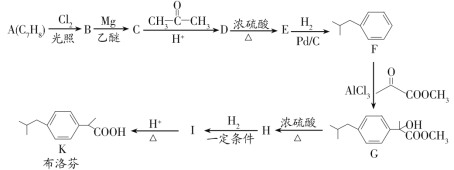
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl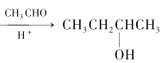
②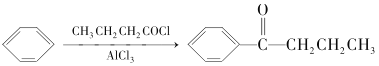 +HCl
+HCl
回答下列问题:
(1)A的化学名称为___,G→H的反应类型为___,H中官能团的名称为__。
(2)分子中所有碳原子可能在同一个平面上的E的结构简式为__。
(3)I→K的化学方程式为___。
(4)写出符合下列条件的D的同分异构体的结构简式__(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;②分子中有一个手性碳原子;③核磁共振氢谱有七组峰。
(5)写出以间二甲苯、CH3COCl和(CH3)2CHMgCl为原料制备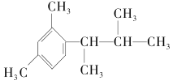 的合成路线:__(无机试剂任选)。
的合成路线:__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。反应的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
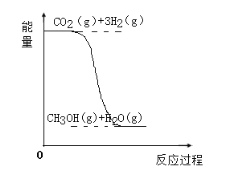
(1)该反应是__反应(填“吸热”或“放热”),判断的理由是___。
(2)某温度时,在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
从反应开始到5min末,用CO2表示的该反应的平均速率为__;反应达平衡时,H2的转化率为__;要提高此反应的速率,可以采取___措施(填写2条)。
(3)若维持(2)的条件不变,能说明该反应已达平衡状态的是__(填序号)。
A.v生成(CH3OH)=v消耗(CO2)
B.CO2、H2、CH3OH、H2O浓度相等的状态
C.CO2、H2、CH3OH、H2O总物质的量保持不变的状态
D.CO2的转化率保持不变的状态
(4)依据原电池原理,将甲醇设计成燃料电池如图:
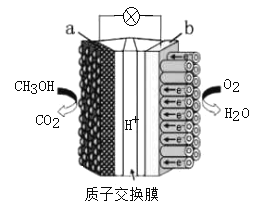
则a为__极(填“正”或“负”);H+从__极区向__极区迁移(用图中字母填);b极上O2发生反应电极反应式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两极各滴入几滴酚酞试液,则:

①电解池中X极上的电极反应式是:_________,在X极附近观察到的现象____________
②Y电极上的电极反应式是:__________________,总反应化学方程式是:_____。
(2) 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,X电极的材料是____。CuSO4溶液的浓度 ____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
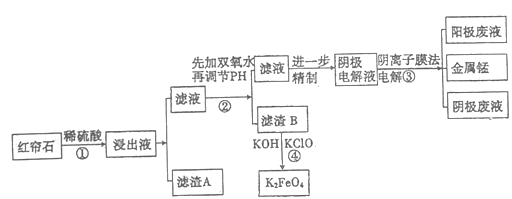
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
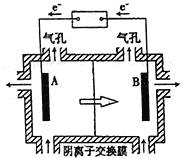
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题,
人们曾认为N+3H![]() 2NH化学反应速率小,原材料利用率低,不可能用于工业化生产。化学家们不断地研究和改进该反应的条件,如催化制,温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。从此,人类能为植物的生长提供足够的氮肥。道解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
2NH化学反应速率小,原材料利用率低,不可能用于工业化生产。化学家们不断地研究和改进该反应的条件,如催化制,温度、压强等,并更新设备,成功地开发了合成氨的生产工艺。从此,人类能为植物的生长提供足够的氮肥。道解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
(1)合成氨的反应属于___________
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(2)下列反应条件的改变对反应速率的影响正确的是___________
A.增大N2的浓度能加快反应速率 B.减小H2的浓度能加快反应速率
C.升高温度能减慢反应速率 D.添加催化剂对反应速率无影响
(3)合成氨为放热反应,下列说法正确的是___________
A.断开H-H键放出能量
B.形成N-H键吸收能量
C.反应物的总能量大于生成物的总能量
D.反应物的总能量小于生成物的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com