
| A. | 能电离出H+的化合物都是酸,能电离出OH-的化合物都是碱 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | NH3、CO2水溶液能够导电,所以NH3、CO2是电解质 | |
| D. | 可用丁达尔效应区别NaCl溶液和Fe(OH)3胶体 |
分析 A.能电离出的阳离子全部是H+的化合物叫做酸;电离出的阴离子全部是OH-的化合物叫做碱;
B.能电离出金属离子(或是铵根离子)和酸根离子的化合物都是盐;
C.电解质需本身能电离;
D.胶体具有丁达尔效应.
解答 解:A.电离出的阳离子全部是H+的化合物叫做酸,能电离出H+的化合物不一定是酸,如硫酸氢钠能电离出氢离子,属于盐,故A错误;
B.能电离出金属离子和酸根离子的化合物都是盐,故B错误;
C.氨气和二氧化碳的水溶液虽然能导电,但是不是其自身导电,是它们与水反应生成的酸或盐导电,二者属于非电解质,故C错误;
D.胶体具有丁达尔效应,溶液没有,可以用此方法区别胶体和溶液,故D正确,
故选D.
点评 本题主要考查的是酸碱盐的定义以及电解质与非电解质的定义,还涉及胶体的性质考查,属于常考题,难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
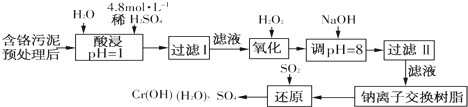
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向负极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 在铝表面的反应为:Al-3e-═Al3+ | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| B. | 向装有2mL 2mol/L AlCl3溶液的试管中,逐滴加入0.01mol/L氨水3mL,产生沉淀且沉淀不溶解,说明氢氧化铝不溶于弱碱 | |
| C. | 在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 | |
| D. | 海带灼烧成灰烬后,加水煮沸2~3min并过滤,滤液中可加入适量的H2O2来氧化I? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
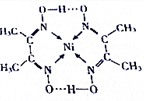 从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:
从物质结构决定性质的视角可预测物质的有关性质.回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
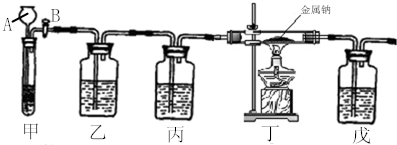
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com