
【题目】辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2 , 以及少量SiO2、Fe2O3等杂质.研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜.主要工艺流程如图: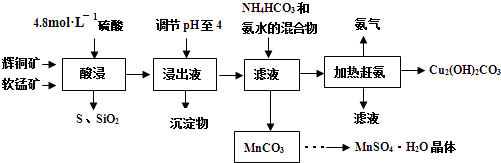
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
Fe3+:1.5~3.2 Mn2+:8.3~9.8 Cu2+:4.4~6.4
④MnSO4H2O溶于1份冷水、0.6份沸水,不溶于乙醇.
(1)实验室配制250mL 4.8molL﹣1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要 .
(2)酸浸时,为了提高浸取率可采取的措施有(任写一点).
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等.写出该反应的化学方程式: .
(4)调节浸出液pH=4的作用是 .
(5)本工艺中可循环使用的物质是(写化学式).
(6)获得的MnSO4H2O晶体需要进一步洗涤、干燥,洗涤时应用洗涤.
(7)测定MnSO4H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为 .
【答案】
(1)250mL容量瓶、胶头滴管
(2)粉碎矿石、适当升高温度或者搅拌
(3)Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O
(4)使Fe3+完全水解生成氢氧化铁沉淀
(5)NH3
(6)酒精
(7)96.57%
【解析】解:酸浸过程中,二氧化硅不反应,分离出来,Cu2S反应生成S单质,Fe2O3溶解成溶液,pH值控制在4时,Fe3+沉淀,过滤得到的滤液成分应为CuSO4和MnSO4等,加热赶氢过后,得到碱式碳酸铜,滤渣为碳酸锰,通过蒸发浓缩、冷却结晶、过滤洗涤等操作即可得到硫酸锰晶体,(1)配制一定物质的量浓度的溶液,必不可少的是容量瓶和胶头滴管,容量瓶要标明规格,本题必须使用250mL容量瓶,所以答案是:250mL容量瓶、胶头滴管;(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,所以答案是:粉碎矿石、适当升高温度或者搅拌;(3)根据信息,MnO2能将金属硫化物中的硫氧化为单质硫,反应物是Cu2S、MnO2、H2SO4 , 生成物是CuSO4、MnSO4、S,把硫化亚铜看成整体,化合价变化是:(1×2+2×1)=4;Mn元素化合价变化是:4﹣2=2,所以二氧化锰化学计量数是2,硫化亚铜的是1,再根据观察法配平其它物质;反应的化学方程式是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O,所以答案是:Cu2S+2MnO2+4H2SO4=2CuSO4+2 MnSO4+S↓+4H2O;(4)根据金属阳离子生成氢氧化物沉淀的pH范围,使Fe3+完全沉淀且Cu2+不沉淀的PH范围是:3.2~4.4,故选择PH=4目的是使Fe3+完全水解生成氢氧化铁沉淀,所以答案是:使Fe3+完全水解生成氢氧化铁沉淀;(5)工艺流程中,加入了氨水,最后又得到了氨气,NH3可循环使用,
所以答案是:NH3;(6)获得的MnSO4H2O晶体需要进一步洗涤、干燥,洗涤时应用酒精,在酒精中,硫酸锰晶体溶解度小,故获得的MnSO4H2O晶体后常用酒精洗涤,目的是减少MnSO4H2O晶体的损失,所以答案是:酒精;(7)测定MnSO4H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀为硫酸钡,其物质的量为:n(BaSO4)=n(SO42﹣)=n(MnSO4H2O)= ![]() mol=0.02mol,则此样品中MnSO4H2O物质的量为:0.02mol×
mol=0.02mol,则此样品中MnSO4H2O物质的量为:0.02mol× ![]() =0.08mol,则样品中MnSO4H2O的纯度=
=0.08mol,则样品中MnSO4H2O的纯度= ![]() ×100%=96.57%;所以答案是:96.57%.
×100%=96.57%;所以答案是:96.57%.


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如下:
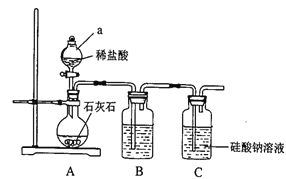
(1)连接好装置后,实验前必须进行的一步操作是_________。仪器a的名称为______。
(2)B装置中盛放的试剂是_________,C中发生反应的化学方程式为_________。
(3)该兴趣小组设计此实验通过_________(填实验现象),可判断碳的非金属性强于硅的非金属性。
(4)该小组的一位同学认为,利用此实验装置及药品,也可以证明非金属性Cl>C>Si,你是否同意该同学的观点?_________(填“同意”或“不同意”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料.
(1)氯气是一种黄绿色气体,化学性质上和氧气有许多相似之处,比如:氯气也能支持燃烧,写出铁丝在氯气中燃烧的方程式: ______ ;氢气在氯气的燃烧观察的现象为: ______
(2)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的![]() 和
和![]() 而失效,漂白粉失效过程的化学反应方程式为: ______
而失效,漂白粉失效过程的化学反应方程式为: ______
(3)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空![]() 、b、c、d中重合部分代表物质间反应,且氯水足量
、b、c、d中重合部分代表物质间反应,且氯水足量![]() .
.

![]() 过程的反应方程式 ______ , e过程中的化学方程式为 ______ .
过程的反应方程式 ______ , e过程中的化学方程式为 ______ .
![]() 过程所观察到的现象为: ______
过程所观察到的现象为: ______
b过程证明了氯水的存在 ______ 微粒
![]()
![]()
![]()
![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论错误的两项是( )
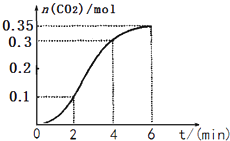
①反应开始2 min内平均反应速率最大
②反应4~6 min内平均反应速率最小
③反应开始4 min内温度对反应速率的影响比浓度大
④反应在第2 min到第4 min间生成CO2的平均反应速率最大
A. ①② B. ②③ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷燃料电池的原理如图所示,下列说法正确的是( )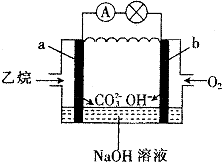
A.a为负极,电极反应式为CH3CH3﹣14e﹣+18OH﹣═2CO![]() +12H2O
+12H2O
B.电子从a极经导线移向b极,再经溶液移向a极
C.电池工作一段时间后电解质溶液的pH增大
D.用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组进行了如图所示的实验,设第一步HNO3的还原产物只有NO.相关分析不正确的是( ) 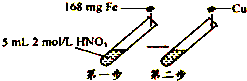
A.第一步反应后溶液中c(NO ![]() )=1.5mol/L(忽略体积变化)
)=1.5mol/L(忽略体积变化)
B.第一步反应后溶液中c(Fe2+):c(Fe3+)=1:1
C.第一步可生成标准状况下的气体44.8 mL
D.第二步可溶解铜48mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验用品的使用或操作正确的是( )
A. 称量NaOH固体时,将NaOH直接放在托盘上的滤纸上
B. 容量瓶用于配制准确浓度的溶液,但不能作为反应容器使用
C. 保存汽油和苯等有机溶剂应选用细口瓶和橡胶塞
D. 用托盘天平称取11.72g食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2 , 发生如下反应: ①2NO(g)+O2(g)2NO2(g)
②2NO2(g)N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )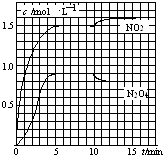
A.前5min反应的平均速率v(N2O4)=0.36mol(Lmin)﹣1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4 , T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能达到实验目的的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | 铜 | 溴水 | 验证浓硫酸具有强氧化性 | |
B | 浓盐酸 | 浓硫酸 | 空气 | 制取并收集HCl | |
C | 浓氨水 | 氧化钙 | 空气 | 制取并收集NH3 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3 溶液 | 验证酸性:硫酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com