
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
某温度下,2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)  3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不
3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不 变。下列不正确的是( )
变。下列不正确的是( )
A.m=2 B.第二次平衡时,Z的浓度为0.2mol•L﹣1
C.又加入1molZ,平衡没有发生移动 D.两次平衡的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
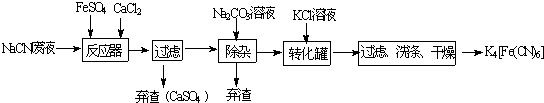
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

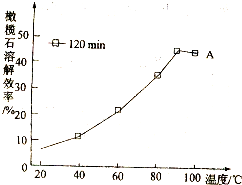
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
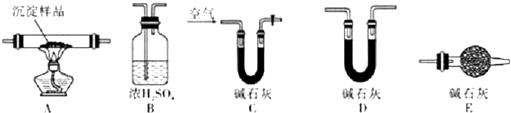
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
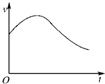 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和KSCN溶液混合 | B. | 锌放入稀硫酸中 | ||
| C. | 铜片放入氯化铁溶液中 | D. | 硫酸铜溶液与氢氧化钠溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | D. | 元素的金属性:A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com