
| A. | 碱在水中的溶解度 | B. | 乙酸溶液的pH | ||
| C. | 合成氨的反应热 | D. | 醋酸钠溶液中的氢氧根离子浓度 |
分析 A、碱的溶解度随温度的升高,溶解度的变化不同;
B、乙酸是弱酸,电离吸热,温度改变会促进弱电解质的电离;
C、根据勒夏特列原理,对所有可逆反应升温平衡都向吸热的方向移动.可逆反应的正反应既有吸热反应也有放热反应,要区别对待;
D、醋酸钠溶液中醋酸根离子水解导致溶液显碱性,水解吸热.
解答 解:A、氢氧化钙的溶解度随温度的升高而降低,故A错误;
B、升温醋酸的电离平衡正向移动,溶液酸性增强,pH减小,故B错误;
C、合成氨反应放热,升温时平衡逆向移动,放热减少,故C错误;
D、升温醋酸根离子水解程度增大,氢氧根离子浓度增大,故D正确;
故选D.
点评 本题考查了温度对溶解度、弱电解质的电离、化学平衡的移动以及盐类水解的影响,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
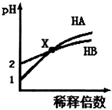
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 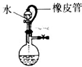 说明该装置气密性良好 | |
| B. |  测定镁铝合金中铝的质量分数 | |
| C. | 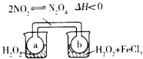 瓶中气体颜色变深,说明H202分解是吸热反应 | |
| D. | 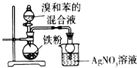 验证苯和溴发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
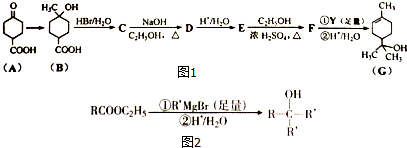
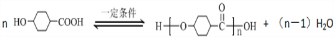 ;
; .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.
中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
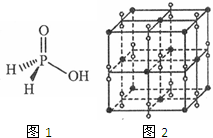
 Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:
前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )
元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )| A. | 质子数为11 | B. | 元素名称为钠 | ||
| C. | 元素符号为 Na | D. | 核外电子数为22.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
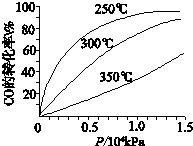 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com