
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
分析 (1)根据FeCl3溶液发生水解反应说明;装置A利用铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水来制备二氧化硫,SO2与FeCl3溶液反应生成硫酸根离子和亚铁离子;
(2)SO2与FeCl3溶液混合,先是二氧化硫与水反应生成亚硫酸,亚硫酸部分电离生成亚硫酸氢根,亚硫酸氢根与三价铁离子结合生成Fe(HSO3)2+离子;
Fe(HSO3)2+离子可以将Fe3+还原为Fe2+,根据氧化还原反应特征书写;
(3)铁氰化钾溶液与二价铁离子反应生成蓝色的Fe3(Fe(CN)6)2;
(4)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
解答 解:(1)因为FeCl3溶液发生水解反应生成氢离子,所以溶液呈酸性,方程式为:Fe3++3H2O?Fe(OH)3+3H+;装置A利用铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水来制备二氧化硫,方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,SO2与FeCl3溶液反应生成硫酸根离子和亚铁离子,反应方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
(2)SO2与FeCl3溶液混合,先是二氧化硫与水反应生成亚硫酸,亚硫酸部分电离生成亚硫酸氢根,亚硫酸氢根与三价铁离子结合生成Fe(HSO3)2+离子,所以方程式为:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+;Fe(HSO3)2+离子可以将Fe3+还原为Fe2+,则由氧化还原反应有升必有降,则离子方程式为:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
故答案为:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+;Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+;
(3)铁氰化钾溶液与二价铁离子反应生成蓝色的Fe3(Fe(CN)6)2,故答案为:生成蓝色沉淀;
(4)综合上述实验分析,升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间,
故答案为:加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
点评 本题考查的探究SO2与FeCl3溶液的反应过程的实验方案设计,为高频考点,把握发生的氧化还原反应及现象的关系为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与等物质的量稀硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2 H2O | |
| B. | 少量CO2通入澄清石灰水中:Ca(OH)2+CO2═CaCO3↓+H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| D. | 碳酸钡溶于稀盐酸中:BaCO3+2H+═Ba2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
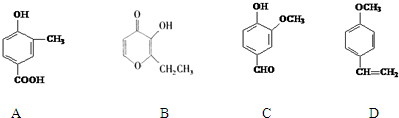
 ;
;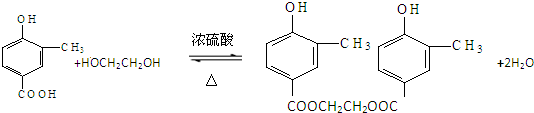 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写成B与足量NaHCO3溶液完全反应的化学方程式:
;写成B与足量NaHCO3溶液完全反应的化学方程式: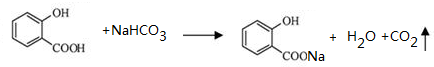 .
. .
. )是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体是F3O2,它具有还原性 | |
| B. | X气体是OF2,它具有氧化性 | |
| C. | 在F2与NaOH反应时,F2既是氧化剂又是还原剂 | |
| D. | 在反应中还有NaFO生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com