
| A、氢氧化钠的摩尔质量是40g |
| B、1mol NaOH的质量是40g/mol |
| C、1g H2和1g N2所含分子数相等 |
| D、等质量的N2、CH4、CO、H2O中CH4所含分子数最多 |
| m |
| M |


科目:高中化学 来源: 题型:
| A、常温常压下,“氢化油”呈液态 |
| B、纤维素和淀粉均属于糖类,它们在人体内水解的最终产物均为葡萄糖 |
| C、可用酒精萃取水中的碘 |
| D、可用灼烧闻气味的方法来区别棉织物和毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3中存在极性共价键 |
| B、稀有气体形成的单质没有化学键 |
| C、氯化钠中各离子均达到8电子稳定结构 |
| D、形成离子键的阴、阳离子间的作用力只存在静电吸引 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、m=
| ||
B、c=
| ||
C、ω=
| ||
D、c=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、13 | B、14 |
| C、15 | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X有三种同位素 |
| B、其中一种同位素的原子质量数为81 |
| C、质量数为79的同位素,其原子质量分数为50% |
| D、X2的平均相对分子质量为159 |
查看答案和解析>>
科目:高中化学 来源: 题型:
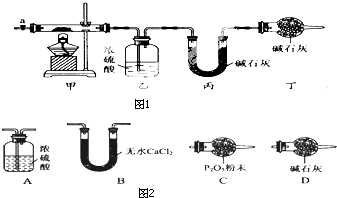 碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
碱式碳酸钴[Cox(OH)y(C03)z]常用作电子材料、磁性材料的添加剂,受热时可分解生喊三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com