
 2CO2(g)+ N2(g)����H��0
2CO2(g)+ N2(g)����H��0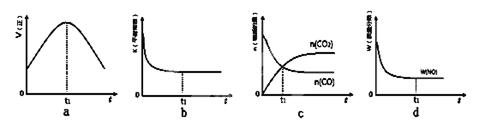
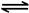 N2O4(g) ��H����56.9 kJ/mol
N2O4(g) ��H����56.9 kJ/mol  2N2(g) + 3H2O(g)��
2N2(g) + 3H2O(g)��
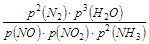 ��2�֣� �� �� C��2�֣�
��2�֣� �� �� C��2�֣�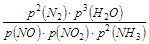



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
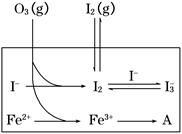
 HOI(aq)����H2
HOI(aq)����H2 I2(aq)��H2O(l)����H3
I2(aq)��H2O(l)����H3 I3��(aq)����ƽ�ⳣ������ʽΪ________��
I3��(aq)����ƽ�ⳣ������ʽΪ________��| ��� | ��Ӧ�� | ��ӦǰpH | ��Ӧ��pH |
| ��1�� | O3��I�� | 5.2 | 11.0 |
| ��2�� | O3��I����Fe2�� | 5.2 | 4.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����ӦA��g��  2B��g������H��������Ӧ�Ļ��ΪEa kJ��mol��1���淴Ӧ�Ļ��ΪEb kJ��mol��1����H����Ea��Eb�� kJ��mol��1 2B��g������H��������Ӧ�Ļ��ΪEa kJ��mol��1���淴Ӧ�Ļ��ΪEb kJ��mol��1����H����Ea��Eb�� kJ��mol��1 |
| B����״���£���0.1 mol��L��1�İ�ˮ�м��������Ȼ�茶��壬�������ҺpH��7����c��NH4+����c��Cl���� |
| C��������пͭ�Ͻ���100 mL pH��1ϡ���ᷴӦ����Ӧ3 sʱ���pH��2�����跴Ӧǰ����Һ��������ֲ��䣬��3 s�ڲ���������ƽ��������33.6 mL��s��1 |
D����Ũ��Ϊ0.1 mol��L��1 HF��Һ��ˮ����ϡ�����У�����ƽ�ⳣ��Ka��HF�����ֲ��䣬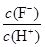 ʼ�ձ������� ʼ�ձ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
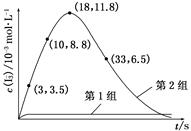
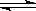 2B(g)��ǰ110 s�ڵķ�Ӧ���̡�
2B(g)��ǰ110 s�ڵķ�Ӧ���̡�
| A��������� | B������������� | C�������¶� | D������A��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
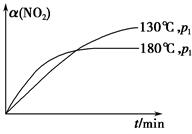
 N2(g)��CO2(g)��2H2O(g)����H����867 kJ��mol��1���÷�Ӧ���������������������Ⱦ����130 ���180 ��ʱ���ֱ�0.50 mol CH4��a mol NO2����1 L���ܱ������з�����Ӧ������й��������±���
N2(g)��CO2(g)��2H2O(g)����H����867 kJ��mol��1���÷�Ӧ���������������������Ⱦ����130 ���180 ��ʱ���ֱ�0.50 mol CH4��a mol NO2����1 L���ܱ������з�����Ӧ������й��������±���| ʵ�� ��� | �¶� | ʱ��/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 �� | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 �� | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
 4NO(g)��CO2(g)��2H2O(g)����H1����574 kJ��mol��1
4NO(g)��CO2(g)��2H2O(g)����H1����574 kJ��mol��1 2N2(g)��CO2(g)��2H2O(g)����H2
2N2(g)��CO2(g)��2H2O(g)����H2�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
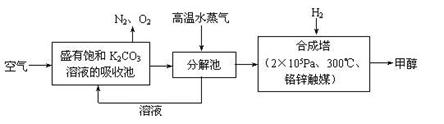

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
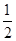 O2(g ) = CO2( g ) ��H����283.0 kJ / mol ��
O2(g ) = CO2( g ) ��H����283.0 kJ / mol ��| A��2:1 | B��1:2 | C��1:1 | D��2:3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��H2O(g)=H2(g)��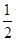 O2(g)��H��242 kJ��mol��1 O2(g)��H��242 kJ��mol��1 |
| B��2H2(g)��O2(g)=2H2O(l)��H����484 kJ��mol��1 |
C��H2(g)��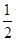 O2(g)=H2O(g)��H��242 kJ��mol��1 O2(g)=H2O(g)��H��242 kJ��mol��1 |
| D��2H2(g)��O2(g)=2H2O(g)��H��484 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2(g);��H=" +57.0" kJ��mol-1��NO2��N2O4��Ũ����ͼ����ʾ��NO2��N2O4��������������Ũ�ȵĹ�ϵ����ͼ��ʾ��
2NO2(g);��H=" +57.0" kJ��mol-1��NO2��N2O4��Ũ����ͼ����ʾ��NO2��N2O4��������������Ũ�ȵĹ�ϵ����ͼ��ʾ��
 2NO2(g) ��H=" +57.0" kJ��mol-1
2NO2(g) ��H=" +57.0" kJ��mol-1 �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com