
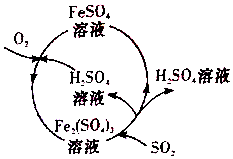
 含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )| A. | 该过程中可得到化工产品H2SO4 | |
| B. | 该工艺流程是除去煤燃烧时产生的SO2 | |
| C. | 该过程中化合价发生改变的元素为Fe和S | |
| D. | 图中涉及到的反应之一为Fe2(SO4)3+SO2+2H2O═2FeSO4+2H2SO4 |
分析 根据工艺流程所示可知,该工艺中Fe2(SO4)3和H2O吸收SO2生成FeSO4和H2SO4,该反应的化学方程式为Fe2(SO4)3+2H2O+SO2=2FeSO4+2H2SO4,据此分析解答.
解答 解:根据工艺流程所示可知,该工艺中Fe2(SO4)3和H2O吸收SO2生成FeSO4和H2SO4,该反应的化学方程式为Fe2(SO4)3+2H2O+SO2=2FeSO4+2H2SO4,该工艺不仅吸收了二氧化硫,还得到了化工产品硫酸亚铁和硫酸,过程中化合价发生变化的元素有氧、铁、硫;所以正确的为ABD,错误为C
故选:C.
点评 本题考查的是化学与环境的知识,难度不大,注意看懂工艺流程图中的进口和出口即可解题.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:实验题
 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最活泼金属,加热生成Li2O2 | |
| B. | 16O2与18O2互为同分异构体 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | HF、HCl、HBr、HI的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
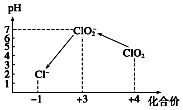 ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2是一种黄绿色到橙黄色的气体,ClO2与Cl2的氧化性相近,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
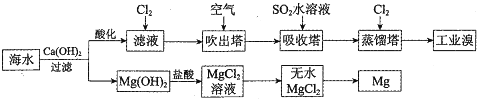
 _.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应
_.通入氯气后,反应的离子方程式是Cl2+2Br-=Br2+2Cl-.海水调节pH过程可以看做发生盐酸和氢氧化钠的中和反应,常温下该反应的平衡常数在c(H2O)看做常数不列入表达式的情况下,数值是1014.调海水pH可提高Cl2的利用率,用平衡移动原理解释其原因是Cl2+H2O=H++Cl-+HClO,增大c(H+),平衡逆向移动,抑制Cl2与水的反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
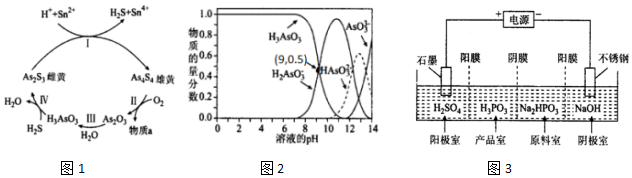
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com