
[化学—选修(二)化学与技术](15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
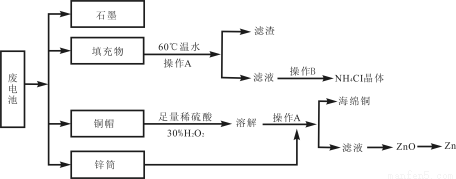
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
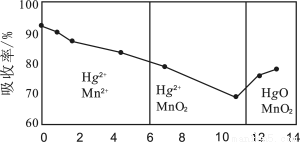
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015-2016学年安徽师大附属中学高二上期中测试化学试卷(解析版) 题型:选择题
下图是制备和研究乙炔性质的实验装置图,有关说法正确的是
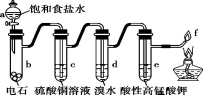
A.用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净
B.c(过量)的作用是除去影响后续实验的杂质
C.d、e褪色原理相同
D.f处产生明亮的蓝色火焰
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期期中测试化学试卷(解析版) 题型:选择题
某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的的是
A.将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.金属钠放入硫酸铜溶液中可以置换出金属铜
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
查看答案和解析>>
科目:高中化学 来源:2016届四川省成都市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(本小题满分14分)
T1温度下,体积为 2L的恒容密闭容器,加入4.00mol X,2.00mol Y,发生化学反应 2X(g)+Y(g)
 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。
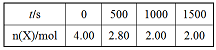
(1)前500s反应速率v(M)= _____________,该反应的平衡常数K=_____________。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________(填序号)
A.X的消耗速率与M的消耗速率相等
B.混合气体的平均相对分子质量不变
C.v(Y)与v(M)的比值不变
D.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____________。
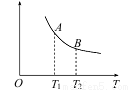
A.Y的逆反应速率
B.M的体积分数
C.混合气体的平均相对分子质量
D.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____________。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____________1.5mol/L(填“>”、“=”或“<”),理由是__________________。
查看答案和解析>>
科目:高中化学 来源:2016届西藏拉萨中学高三上学期第二次月考化学试卷(解析版) 题型:选择题
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
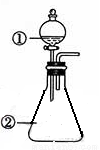
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:选择题
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列说法正确的是
A.X、Y的简单离子半径:r(X2﹣)>r(Y+)
B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C.M与X形成的化合物对应的水化物一定是强酸
D.M的气态氢化物比N的气态氢化物稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:填空题
天然矿物芒硝化学式为Na2SO4·10H2O,为无色晶体,易溶于水。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
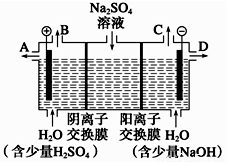
(1)该电解槽的阴极电极反应式为 。此时通过阴离子交换膜的离子数__________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)所得到的浓氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)____________导出。
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则该电池负极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:选择题
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
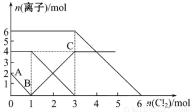
A.离子的还原性顺序为:Fe2+>Br->I-
B.原混合溶液中FeBr2的物质的量为4mol
C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com