
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是________,C2B2的电子式为________。
(2)B、C、D、F的离子半径由大到小的顺序是________(用离子符号表示)。
(3)E和F相比,非金属性强的是________(用元素符号表示),下列事实能证明这一结论的是________(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为________(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为__________________________。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为________,pH=10的乙溶液中由水电离产生的c(OH-)=________mol·L-1。
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:填空题
有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:
A________,B________,C________,D________。
(2)写出C、D两种元素基态原子核外电子轨道表示式。
C_______________________________________________________________,
D_______________________________________________________________。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式____________________________________________。
(4)写出B元素单质和氢化物的电子式:单质________,氢化物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。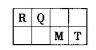
(1)人的汗液中台有T的简单离子,其离子结构示意图为_________________;元素M在元素周期表中的位置是___________________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为__________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲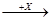 乙
乙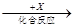 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
①R ②Q2 ③M ④T2
(5)工业上,常利用。RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。
已知:2RO(g)+O2(g)=2RO2(g) △H=-akJ·mol-l
M(s)+O2(g)=MO2(g) △H=-bkJ·mol-l
则反应2RO(g)+MO2(g)=2RO2(g)+M(s) △H=___________。
(6)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。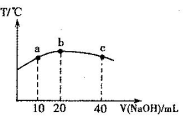
①HTO的电离常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:c(TO—)= c(Na+)
④从b点到c点,混合溶液中一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2Y对应水化物的碱性比LiOH________。
(3)Z2X属于________(填“共价”或“离子”)化合物。
(4)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:
A________、B________、C________、D________。
(2)E在元素周期表中的位置:_________________________________________________。
(3)F离子结构示意图:_____________________________________________________。
(4)A、B组成的最简单化合物的名称是____________________________________________。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为___________________________________________________________。
(6)能说明E的非金属性比F的非金属性____(填“强”或“弱”)的事实是________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B两元素,A的原子序数为x,A、B所在周期元素的种类分别为m和n,若A、B同在第ⅠA族,当B在A的上周期时,B的原子序数为________,当B在A的下周期时,B的原子序数为________;若A、B同在第ⅦA族,当B在A的上周期时,B的原子序数为________,当B在A的下周期时,B的原子序数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。请回答下列问题:
(1)若X单质为空气的主要成分之一,则W原子结构示意图为 。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,则这两种离子的符号是 、 。
(3)若Na与Y和Z的单质分别反应可以生产摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为 ,所含化学键的类型为
(4)Y元素在周期表中可能处于第 纵行(写出所有可能纵行数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四种短周期非金属元素A、B、C、D原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是
(2)化合物CA3的电子式是 ,BD2分子的结构式为
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1 HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com