

| A. | Na2S4O6、H2O、Na2S2O3、Au2O、NaOH | |
| B. | Na2S2O3、H2O、Na2S4O6、Au2O、NaOH | |
| C. | Na2S2O3、NaOH、Na2S4O6、Au2O、H2O | |
| D. | 当1mol Au2O3完全反应时,转移电子的物质的量为8mol |
分析 Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,由于2Na2S2O3→1Na2S4O6,根据钠元素守恒可知NaOH是生成物,由氢元素守恒可知水是反应物,Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高4×(2.5-2)=2,根据化合价升降相等,可知Au2O3系数为1,Na2S4O6系数为2,以此解答该题.
解答 解:Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,由于2Na2S2O3→1Na2S4O6,根据钠元素守恒可知NaOH是生成物,由氢元素守恒可知水是反应物,Na2S2O3→Na2S4O6中,S硫元素平均化合价由+2价升高为+2.5价,化合价总共升高4×(2.5-2)=2,根据化合价升降相等,可知Au2O3系数为1,Na2S4O6系数为2,根据Au守恒可知Au2O系数为1,根据硫元素守恒可知Na2S2O3系数为4,根据元素Na元素守恒可知NaOH的系数为4,根据H元素守恒可知H2O系数为2,反应方程式为Au2O3+4Na2S2O3+2H2O=Au2O+2Na2S4O6+4NaOH,
当1mol Au2O3完全反应时,转移电子的物质的量为4mol.
故选B.
点评 本题考查氧化还原反应的计算、配平等,为高频考点,侧重于学生的分析能力的考查,难度中等,根据化合价、元素守恒判断反应物、生成物是解题的关键.掌握化合价升降法配平氧化还原反应方程式.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导致易拉罐变瘪的离子反应是:CO2+OH-═HCO3- | |
| B. | 导致易拉罐又鼓起来的反应是:Al3++3HCO3-═Al(OH)3+3CO2 | |
| C. | 上述过程中与NaOH溶液反应的物质有三种,且反应结束后的溶液显碱性 | |
| D. | 若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂会改变反应的焓变 | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 | |
| C. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol | |
| D. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27 g铝原子最外层电子总数为NA | |
| B. | 2.8 g N2和2.8 g NO2所含电子数均为1.4NA | |
| C. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| D. | 标准状况下,22.4 L甲烷的分子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 纯碱 | Al(OH)3胶体 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 小苏打 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明Fe2+既有氧化性又有还原性 | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
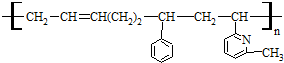
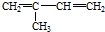
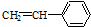
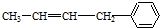
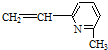
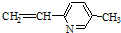
| A. | ②③⑥ | B. | ①②⑥ | C. | ②③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com