
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| D、常温常压下,18g H2O含有的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
- 3 |
+ 4 |
- 2 |
+ 4 |
2- 4 |
| ||
2- 2 |
+ 4 |
2- 3 |
| A、①③ | B、①④ | C、①⑥ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:甲<乙 |
| B、非金属性:乙<丁 |
| C、最高价氧化物的水化物的酸性:丙<丁 |
| D、最外层电子数:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铵态氮肥不能与草木灰混合施用 |
| B、乙醇可通过淀粉等生物原料发酵制得,属于可再生资源 |
| C、人造纤维、合成纤维、玻璃纤维和光导纤维都是有机高分子化合物 |
| D、MgO的熔点很高,可用于制作耐高温材料,但工业上不用MgO制镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| H2O |
| HCN |
| 3 |
| 2 |
| 催化剂 |
| 425℃~510℃ |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和10mL 0.1mol?L-1醋酸与中和100mL 0.01mol?L-1的醋酸所需同种碱溶液的量不同 |
| B、常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C、常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D、常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 恒容条件下,已知该图中温度T1>T2,则纵轴可表示正反应速率 |
B、 恒温下,已知该图中压强p1>p2,则纵轴可表示NH3的体积分数 |
C、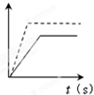 恒温、恒容下,该图中虚线表示开始充入2mol N2和3mol H2,实线表示开始充入1mol N2和3mol H2,则纵轴可表示H2的转化率 |
D、 该图可表示平衡后,t1时在恒温恒压下充入He气时正、逆反应速率的变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com