
| A. | 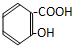 | B. | 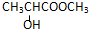 | ||
| C. | CH2=CH-COOH | D. | 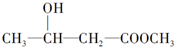 |
分析 酚-OH、-COOH具有酸性,-OH、-COOH可发生酯化反应,-OH可发生消去反应,但与-OH相连的C的邻位C上必须有H,以此来解答.
解答 解:A.含酚-OH、-COOH,具有酸性、可发生酯化反应,但不能发生消去反应,故A不选;
B.含-COOH具有酸性,含-OH、-COOH可发生酯化反应,且与-OH相连的C的邻位C上有H,可发生消去反应,故B选;
C.含-COOH,具有酸性、可发生酯化反应,但不能发生消去反应,故C不选;
D.含-OH可发生酯化反应,且与-OH相连的C的邻位C上有H,可发生消去反应,但不具有酸性,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、醇、羧酸性质的考查,题目难度不大,注意醇消去反应的结构特点.


科目:高中化学 来源: 题型:选择题
| A. | 原电池中电子流出的极为负极,发生氧化反应 | |
| B. | 原电池中阴离子向正极移动 | |
| C. | 原电池是将电能转化为化学能的装置 | |
| D. | 原电池正极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
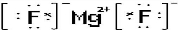 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
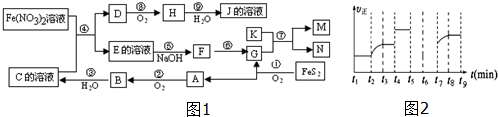
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 投料比$\frac{n{H}_{2}p}{nC{O}_{2}p}$ | 500K | 600K | 700K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将1.12L Cl2溶于水,转移电子数为0.05NA | |
| B. | 将含等物质的量的KHCO3和Ba(OH)2溶液混合,离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-一定能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
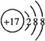 ,E元素的周期表位置第三周期ⅥA族,乙的电子式为
,E元素的周期表位置第三周期ⅥA族,乙的电子式为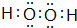 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com