


 ¾ŁŅ»·“ȿʌĩ°Ł·Ö³å“Ģ¾ķĻµĮŠ“š°ø
¾ŁŅ»·“ȿʌĩ°Ł·Ö³å“Ģ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¢Ł¢Ś | B£®¢Ł¢Ü | C£®¢Ś¢Ū | D£®¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Q1£«Q2£«Q3 |
| B£®1.5Q1£0.5Q2£«0.5Q3 |
| C£®0.5Q1£1.5Q2£«0.5Q3 |
| D£®0.5(Q1£«Q2£«Q3) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
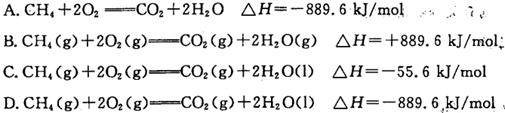
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®æŖ·¢ĄūÓĆĢ«ŃōÄÜ”¢ÉśĪļÖŹÄܵČĒå½ąÄÜŌ“ |
| B£®³ä·ÖæŖ·¢ĄūÓĆ“æĢģČ»ĻĖĪ¬£¬Ķ£Ö¹Ź¹ÓĆø÷ÖÖ»ÆѧŗĻ³É²ÄĮĻ |
| C£®»ż¼«·¢Õ¹¹«¹²½»ĶØ£¬³«µ¼ĀĢÉ«³öŠŠ |
| D£®ŃŠÖĘæŖ·¢Č¼ĮĻµē³ŲĘū³µ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®pH£½5.6µÄCH3COOHÓėCH3COONa»ģŗĻČÜŅŗÖŠ£ŗc(Na£«)<c(CH3COO£) |
B£®½«pH£½3µÄ“×ĖįĻ”ŹĶĪŖpH£½4µÄ¹ż³ĢÖŠ£¬ ±ČÖµ²»±ä ±ČÖµ²»±ä |
| C£®ÅØ¶Č¾łĪŖ0.1 mol”¤L£1µÄCH3COOHŗĶCH3COONaČÜŅŗµČĢå»ż»ģŗĻŗó£ŗc(CH3COO£)£«c(CH3COOH)£½2c(Na£«) |
| D£®a mL pH£½3µÄ“×ĖįČÜŅŗÓėb mL pH£½11µÄNaOHČÜŅŗĒ”ŗĆĶźČ«ÖŠŗĶŹ±£¬a£½b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
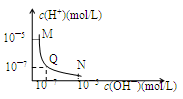
| A£®MµćĖłŹ¾ČÜŅŗµÄµ¼µēÄÜĮ¦ĒæÓŚQµć |
| B£®NµćĖłŹ¾ČÜŅŗÖŠc(CH3COOØD)£¾c(Na£«) |
| C£®QµćĻūŗÄNaOHČÜŅŗµÄĢå»żµČÓŚ“×ĖįČÜŅŗµÄĢå»ż |
| D£®MµćŗĶNµćĖłŹ¾ČÜŅŗÖŠH2OµÄµēĄė³Ģ¶ČĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 NH3”¤H2O(aq)Ź®H+(aq) ¦¤H£½bkJ”¤mol-1
NH3”¤H2O(aq)Ź®H+(aq) ¦¤H£½bkJ”¤mol-1| A£®Ėę×ÅŃĪĖįµÄÖšµĪ¼ÓČė£¬Ė®µēĄėµÄc(OH”Ŗ)×ÜŹĒÖš½„¼õŠ” |
| B£®µ±µĪČė10mLŃĪĖįŹ±£¬ČÜŅŗÖŠ£ŗc(NH4+)Ź®c(NH3”¤H2O)£½2c(Cl”Ŗ) |
| C£®µ±µĪČė20mLŃĪĖįŹ±£¬ČÜŅŗÖŠ£ŗc(Cl”Ŗ)Ź®c(H+)£½c(NH4+)Ź®c(OH”Ŗ) |
D£®Ė®µēĄė¹ż³ĢµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗH2O(1)  H+(aq)+OH”Ŗ(aq) ¦¤H£½( b£a) kJ”¤mol-1 H+(aq)+OH”Ŗ(aq) ¦¤H£½( b£a) kJ”¤mol-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com