
| A. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He分别含有1和2个质子 | |
| C. | ${\;}_{2}^{3}$He 和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{3}$He的最外层电子数为1,所以${\;}_{2}^{3}$He 具有较强的金属性 |
分析 A、${\;}_{2}^{3}He$代表原子核内有2个质子和1个中子的氦原子;
B、两者同属于一种元素,质子数都为2;
C、有相同质子数,不同中子数的原子互为同位素;
D、原子中电子数等于质子数,是2,据此解答即可.
解答 解:A、${\;}_{2}^{3}He$代表原子核内有2个质子和1个中子的氦原子,故A错误;
B、同种元素的不同种原子,质子数相同,中子数不同,质子数均为2,故B错误;
C、质子数相同,中子数不同,互为同位素,故C正确;
D、原子中电子数等于质子数,均是2,达到了稳定结构,不具有较强的金属性,故D错误,故选C.
点评 本题主要考查原子符号的意义,同位素的概念,难度不大.要牢记原子符号的意义.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 试管内壁的银镜可用玻璃棒将其刮下或浸泡氨水的方法清洗去除 | |
| B. | 为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 | |
| C. | 为检验CO气体的纯度,用排空气法收集一试管气体,然后移近酒精灯火焰点燃.听有无尖锐爆鸣声 | |
| D. | 用pH计、浊度计(浊度即水的浞浊程度.浊度计是测定水浊度的装置)均不可用于探究硫代硫酸钠与硫酸反应速率的影响因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 当v逆(X)=2v正(Z),可以说明反应达平衡 | |
| B. | 反应前2 min的平均速率v(Z)=4.0×10?3 mol•L?1•min?1 | |
| C. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 | |
| D. | 该反应在350℃时的平衡常数小于1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
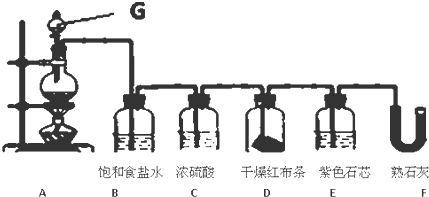
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
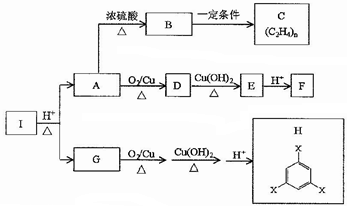
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

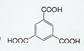
 ,D的结构式:
,D的结构式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol•L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com