
将Al片和Cu片用导线相连,一组插入稀H2SO4溶液中,一组插入浓NaOH溶液中,分别形成了原电池。则在这两个原电池中
| A.Al片均作阴极 |
| B.电解质溶液的pH均逐渐升高 |
| C.Cu片上均有气泡放出 |
| D.电路中流过等物质的量的电子时,放出等体积的气体 |
C
解析试题分析:两种情况均符合原电池的构成条件。都形成了原电池。原电池的电极为正极、负极。将Al片和 Cu片用导线相连,插入稀H2SO4溶液中。Al作负极,反应氧化反应2Al-6e-=2Al3+;Cu作正极,在Cu上发生反应:6H++e-=3H2↑。总反应式为2Al+6H+=2Al3++3H2↑。所以在Cu上有气泡产生。因为H+不断消耗,所以溶液的酸性减弱,pH不断增大;将Al片和Cu片用导线相连,插入浓NaOH溶液中,Al作负极。发生反应:Al-3e-+4OH-=AlO2-+2H2O;在正极上发生反应:6H2O+6e-=4OH-+3H2↑。在Cu上有气泡产生。总方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。因为OH-不断消耗,所以溶液的碱性减弱,pH不断减小;若电路中流过等物质的量的电子时,两种情况下都是H+得到电子,产生氢气,所以氢气的物质的量相等,但放出气体的体积由于条件可能相同,也可能不同,所以体积无法确定。综上所述正确选项为C。
考点:考查原电池的反应原理的知识。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:单选题
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
| A.a为直流电源的负极 |
| B.阴极的电极反应式为:2HSO3-+2H++e-=S2O42-+2H2O |
| C.阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
| D.电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列描述不符合生产、生活实际的是
| A.家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解水制氢气时,用铜作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验现象的描述中,正确的是
A.如图所示装置中,锌电极上一定没有气泡生成 |
| B.向CaCl2饱和溶液中通入少量CO2,溶液中会出现白色沉淀 |
| C.做氯化铵分解实验时,加热试管底部,试管口处有晶体出现 |
| D.向蛋白质溶液中滴加足量饱和NaCl溶液的过程中无固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用图甲装置电解一定量的CuSO4溶液,M、N为惰性电极。电解过程实验数据如图乙所示。X轴表示电解过程中转移电子的物质的量,Y轴表示电解过程产生气体的总体积。则下列说法不正确的是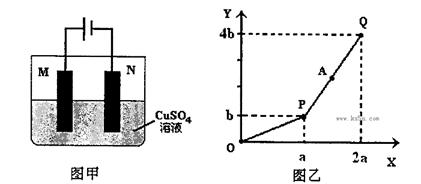
| A.电解过程中N电极表面先有红色物质生成,后有气泡产生 |
| B.A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态 |
| C.Q点时M、N两电极上产生的气体在相同条件下体积相同 |
| D.若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用吸附了氢气的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是 ( )
| A.放电时,负极的电极反应式为H2-2e-+2OH-=2H2O |
| B.充电时,阳极的电极反应式为Ni(OH)2+OH--e-=NiO(OH)+H2O |
| C.放电时,OH-移向镍电极 |
| D.充电时,将电池的碳电极与外电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是 ( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com