
|
已知SO2(g)+1/2O2(g) | |
| [ ] | |
A. |
该条件下加入2 mol SO2与1 mol O2充分反应,放出热量为196.0 kJ |
B. |
若不加入催化剂,ΔH将不等于-98.0 kJ/mol |
C. |
升高温度平衡向逆反应方向移动 |
D. |
工业生产中采取增大压强的方法,提高SO2的转化率 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.| 3.2 |
| at |
| 3.2 |
| at |
查看答案和解析>>
科目:高中化学 来源: 题型:
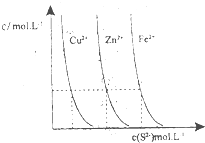 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:| 弱酸化学式 | CH3COOH | HCN | H2CO |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
| 放电 |
| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)pH相同的溶液,其物质的量浓度的关系是H2SO4 CH3COOH
常温下,pH=3的盐酸溶液中水的电离程度 PH=11的NaOH溶液中水的电离程度(填“> ”“ <”“=” )
(2)已知SO2(g)+ 1/2 O2(g) ![]() SO3(g) △H = -98.30kJ/mol,现将4molSO2与一定量O2混合后充分反应,当放出314.56kJ热量时,SO2的转化率为 。
SO3(g) △H = -98.30kJ/mol,现将4molSO2与一定量O2混合后充分反应,当放出314.56kJ热量时,SO2的转化率为 。
(3)下列三组溶液
①20ml、0.1mol/LHCl + 20ml、0.1mol/LNH3·H2O
②10ml、0.2mol/LHCl + 30ml、0.1mol/LNaOH
③10ml、0.1mol/L H2SO4 + 30ml、0.1mol/LNH3·H2O
发生反应的反应热ΔH1、ΔH2、ΔH3大小关系为 。
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com