I.下列实验设计、操作或实验现象合理的是
(填序号).
A.将纤维素和硫酸混合共热后的液体,取出少许,加入新制的Cu(OH)
2悬浊液加热,观察是否有砖红色沉淀生成,以证明纤维素水解生成葡萄糖
B.液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入足量稀HNO
3,再加入AgNO
3溶液检验Br
-的生成
C.检验甲酸中是否混有甲醛,可向样品中加入足量NaOH溶液以中和HCOOH,再做银镜反应实验
D.分离苯和苯酚的混合液,加入适量浓溴水,过滤,即可分离
E.将铜丝在酒精灯外焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
F.提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离
G.在试管中加入2mL10%的CuSO
4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,证明乙醛的性质
Ⅱ.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl
2?6C
2H
5OH.
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点(℃) |
34.7 |
78.5 |
118 |
77.1 |
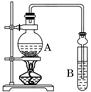
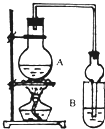
某课外活动小组设计的实验室制取较多量乙酸乙酯的装置如图所示,A中放有过量乙醇、无水醋酸钠和浓硫酸,B中放有饱和碳酸钠溶液.试回答:
(1)A中浓硫酸的作用是
反应中加入的乙醇是过量的,其目的是
.
(2)若用同位素
18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示
18O位置的化学反应方程式
;
(3)该实验中使用球形管除起冷凝作用外,另一重要作用是
.
(4)反应结束后D中的现象是
.
(5)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出
;再加入(此空从下列选项中选择)
,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A 五氧化二磷 B 碱石灰 C 无水硫酸钠 D 生石灰.

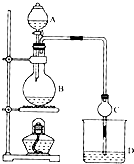 某课外活动小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.请回答:
某课外活动小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.请回答:

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案

 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是