
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 A.含离子键的一定为离子化合物;
B.金属元素跟非金属元素可形成共价化合物;
C.离子化合物中可能不存在金属离子;
D.溶于水可以导电的化合物可能为共价化合物.
解答 解:A.含离子键的一定为离子化合物,则共价化合物中不含离子键,故A正确;
B.金属元素跟非金属元素可形成共价化合物,如氯化铝为共价化合物,故B错误;
C.离子化合物中可能不存在金属离子,如铵盐为离子化合物,铵盐中不存在金属离子,故C错误;
D.溶于水可以导电的化合物可能为共价化合物,如HCl溶于水导电,HCl为共价化合物,故D错误;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L N2和17g NH3中所含有的N原子数相同 | |
| B. | 9g H2O和0.5mol O2中含的原子数相同 | |
| C. | 20℃时,相同体积的N2、O2一定含有相同的分子数 | |
| D. | 在常温常压下,20mL CH4与60mL O2所含的原子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
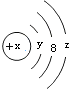
| A. | Y=2 | B. | 若X=14,它的氢化物的化学式为H2X | ||
| C. | 若X=18,则Z=8 | D. | 若X=17,它的氧化物化学式为W2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
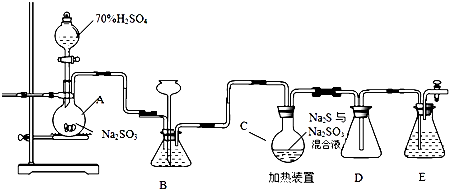
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、NO2均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 汽油、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
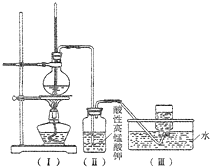 如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.
如图,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中出现棕色、黑色现象.过一段时间后,发现硫酸酸化的高锰酸钾溶液褪色.甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为酸性高锰酸钾溶液褪色,不能证明乙烯被酸性高锰酸钾溶液氧化了.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com