


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、工作一段时间后,C烧杯的PH减小 |
| B、电极I发生还原反应 |
| C、盐桥中的K+移向A烧杯 |
D、电流方向:电极Ⅳ→ →电极I →电极I |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋用氢氧化钠溶液滴定开始时,溶液的pH通常变化缓慢,当接近完全反应时(即滴定终点),pH出现突变,称为滴定突跃 |
| B、当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
| C、油墨是由多种色素按一定比例混合而成的,某同学欲用纸层析的方法将其主要色素分离开来,可选用的展开剂的物质是丙酮和盐酸 |
| D、提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
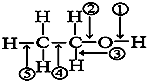
| A、和金属钠作用时,键①断裂 |
| B、和浓硫酸共热至170℃时,键②和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键②断裂 |
| D、在银催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有Na+离子个数为0.02 NA |
| C、含有阿伏德罗常数个微粒的物质就是1摩尔 |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol?L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和Na2SO4溶液 |
| B、福尔马林溶液 |
| C、18.4 mol/L的硫酸溶液 |
| D、1.0mol/L的CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com