
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 常温下32g含有少量臭氧的氧气中,共含有2NA个氧原子
C. 56g铁粉 与足量水蒸气反应,转移的电子数为3NA
D. 100mL0.1mol/L醋酸溶液含有的氢离子数为0.01NA
【答案】B
【解析】
氦气是单原子分子,含有NA个氦原子的氦气的物质的量是1mol;32g含有少量臭氧的氧气中只含氧原子,氧原子的物质的量是![]() ;铁粉与足量水蒸气反应生成四氧化三铁和氢气,方程式是
;铁粉与足量水蒸气反应生成四氧化三铁和氢气,方程式是![]() ;醋酸是弱酸,在水溶液中部分电离。
;醋酸是弱酸,在水溶液中部分电离。
氦气是单原子分子,含有NA个氦原子的氦气的物质的量是1mol,在标准状况下的体积约为22.4L,故A错误;32g含有少量臭氧的氧气中只含氧原子,氧原子的物质的量是![]() ,共含有2NA个氧原子,故B正确;铁粉与足量水蒸气反应方程式是
,共含有2NA个氧原子,故B正确;铁粉与足量水蒸气反应方程式是![]() ,根据方程式,1mol铁粉与足量水蒸气反应,转移的电子数为
,根据方程式,1mol铁粉与足量水蒸气反应,转移的电子数为![]() NA ,故C错误;醋酸是弱酸,在水溶液中部分电离,100mL0.1mol/L醋酸溶液含有的氢离子数小于0.01NA,故D错误。
NA ,故C错误;醋酸是弱酸,在水溶液中部分电离,100mL0.1mol/L醋酸溶液含有的氢离子数小于0.01NA,故D错误。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于反应自发性的说法正确的是
A. △H<0、△S>0的反应,有利于自发进行
B. 化合反应都是放热反应,分解反应都是吸热反应
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 自发反应在任何条件下都能自动进行,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl
B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br-
D. .上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Q适用于治疗高血压、心绞痛,可由有机物P和L制备。
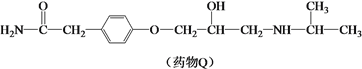
(1)有机物P的合成路线如下。

已知:![]() (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
① A的分子式为C3H8O,其所含的官能团是_______。
② B的核磁共振氢谱只有一个吸收峰,其结构简式是_______。
③ 由D生成有机物P的反应类型是_______。
(2)有机物L的合成路线如下。
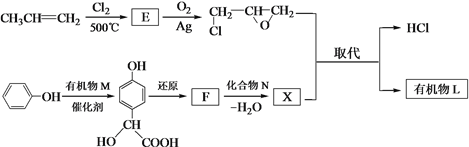
已知:![]()
① 生成E的化学方程式是_______。
② ![]() 与有机物M发生加成反应, M的结构简式为_______。
与有机物M发生加成反应, M的结构简式为_______。
③ F含羧基,化合物N是_______。
④ 生成有机物L的化学方程式是_______。
(3)以![]() 为起始原料合成聚合物甲的路线如下:
为起始原料合成聚合物甲的路线如下:
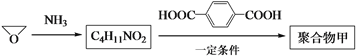
写出聚合物甲的结构简式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如图装置吸收转化SO2(A、B 为惰性电极)。下列说法错误的是( )

A. a为电源的正极
B. B 极上发生氧化反应
C. 离子交换膜为阳离子交换膜
D. A极区溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态+2价铜离子M能层电子排布式是___________;第4周期中基态原子未成对电子数与铜原子相同的元素有________种。
(2)Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒_________。SCN-对应的酸有硫氰酸(H-S-CN)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是_______(填名称),原因是_____________________。
(3)Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为__________;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是__________。
(4)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,前者熔点较高,其原因是___________。
(5)Cu3N 的晶胞(立方)结构如下图所示:
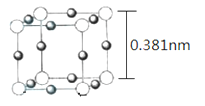
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
②Cu3N 晶体的密度为____________ g·cm-3。(NA表示阿伏伽德罗常数的值,列出计算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq) ![]() 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)
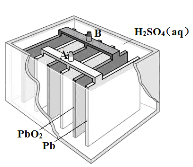
下列说法不正确的是
A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l)
B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接
C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接
D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com