
【题目】为研究(NH4)2SO4和NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同浓度的NaOH溶液25.0 mL,加热并完全反应,产生NH3的体积(NH3的体积已折算成标准状况,不考虑NH3在水中的溶解)如下表:
实验序号 | I | II | III | IV |
NaOH体积(mL) | 25.0 | 25.0 | 25.0 | 25.0 |
样品质量(g) | 3.62 | 5.43 | 7.24 | 10.86 |
NH3体积(mL) | 896 | 1344 | 1344 | 896 |
(1)样品中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(2)NaOH溶液的物质的量浓度为 。
【答案】(1)1:2 (2)4.00mol/L
【解析】
试题分析:(1)NH4HSO4电离方程式为NH4HSO4 = NH4+ +H++SO42-,加入NaOH过程中先是发生H++OH-=H2O,然后发生NH4+ +OH-![]() NH3↑+H2O。按Ⅰ组数据计算,设n〔(NH4)2SO4〕和n(NH4HSO4)分别为x、y,依题意有132x+115y=3.62、2x+y=0.896L÷22.4L/mol,解得x=0.01mol、y=0.02mol,所以n((NH4)2SO4) ︰ n(NH4HSO4) = 0.01mol:0.02mol=1︰2。
NH3↑+H2O。按Ⅰ组数据计算,设n〔(NH4)2SO4〕和n(NH4HSO4)分别为x、y,依题意有132x+115y=3.62、2x+y=0.896L÷22.4L/mol,解得x=0.01mol、y=0.02mol,所以n((NH4)2SO4) ︰ n(NH4HSO4) = 0.01mol:0.02mol=1︰2。
(4))应选NaOH已完全反应的第Ⅳ组,据Ⅳ的数据,10.86g样品中共含:n(H+)=n(NH4HSO4)=0.02×3=0.06 ,据H++OH-=H2O知消耗NaOH 0.06 mol,据NH4+ +OH-![]() NH3↑+H2O知生成0.896 L NH3消耗NaOH:0.896L÷22.4L/mol=0.04 mol,NaOH溶液的物质的量浓度为:(0.06+0.04)÷0.025L=4.00mol/L。
NH3↑+H2O知生成0.896 L NH3消耗NaOH:0.896L÷22.4L/mol=0.04 mol,NaOH溶液的物质的量浓度为:(0.06+0.04)÷0.025L=4.00mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。A、B、C、D、F均为气体,其中A的相对分子质量为16,F是黄绿色单质;E是最常见的液体;X微溶于水,反应①是工业生产中的重要反应,反应②常用于D的检验。

请回答下列问题:
(1)C的电子式为 。
(2)I的化学式为 。
(3)写出反应①的化学方程式: 。
(4)写出反应②的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,N2(g)和H2(g)反应生成2molNH3(g)放出92.4kJ热量。在相同条件下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的密闭容器中通入0.5molN2、1.5molH2和1molNH3,相同条件下达到平衡时放出热量为Q2kJ。则下列关系式正确的是
A. 2Q2=Q1=92.4 B. Q2<Q1<92.4
C. Ql<Q2<92.4 D. Ql=Q2<92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐、电解质分类顺序排列的是( )
A.硫酸、纯碱、明矾、二氧化硫
B.硝酸、烧碱、碳酸钙、氯化钠
C.醋酸、苛性钠、碳酸钠、氨水
D.盐酸、熟石灰、苛性钠、乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
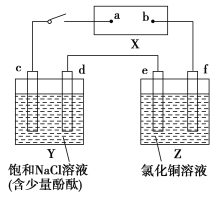
(1)①电源上b为____________极(用“正”、“负”、“阴”或“阳”填空)。
②Z槽中e为____________极(同上)。
③连接Y、Z槽线路中,电子流动的方向是d____________e(用“→”或“←”填空)。
(2)①写出c极上反应的电极反应式:_______________________________。
②写出Y槽中总反应的化学方程式:________________________________。
③写出Z槽中e极上反应的电极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定是碱性的是( )
A. pH=6的某电解质的溶液 B. c(OH-)>1×10-7mol/L
C. 溶液中含有OH- D. 溶液中c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)250C、101kPa时,____________纯物质完全燃烧生成__________时所放出的热量,叫做该物质的燃烧热。
(2)已知:①P4(s,白磷)+5O2(g)=P4O10(s)△H=—2983.2kJmol-1
②P(s,红磷)+5/4O2(g)=1/4P4O10(s)△H=—738.5kJmol-1
写出白磷转化为红磷的热化学方程式: __。
(3)已知:①Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g)△H1=-26.7kJ/mol
②3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g)△H2=-50.75kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H3=-36.5kJ/mol
计算反应:2FeO(s)+2CO(g)==2Fe(s)+2CO2(g)的△H =_ __
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com