

分析 (1)辛烷C8H18燃烧生成1mol水蒸气时放热569.1KJ,据此计算1mol辛烷燃烧放热多少,再来书写热化学方程式;
(2)混合动力车上坡或加速时,是原电池中,正极发得电子发生还原反应,NiOOH得电子生成Ni(OH)2,同时生成氢氧根离子,溶液的pH变化增大;
(3)在电解池中,阴极是阳离子发生得电子得还原反应,根据电子守恒来计算氢气消耗量和Cu2O的理论产量之间的关系;
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,可以利用原电池原理牺牲阳极的阴极保护法进行保护;在电解池中,阴极是被保护的电极,可以采用外加电源的阴极保护法进行保护.
解答 解:(1)辛烷C8H18燃烧生成1mol水蒸气时放热569.1KJ,1mol辛烷燃烧生成9mol水,所以1mol辛烷燃烧放热放热569.1KJ×9=5 121.9 kJ,其热化学方程式为:C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5 121.9 kJ•mol-1,
故答案为:C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5 121.9 kJ•mol-1;
(2)混合动力车上坡或加速时,是原电池中,乙极是正极,得电子发生还原反应,NiOOH得电子生成Ni(OH)2,同时生成氢氧根离子,溶液的pH变化增大,故答案为:增大;NiOOH+H2O+e-═Ni(OH)2+OH-;
(3)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑,根据电子守恒,当蓄电池中有1mol H2被消耗时,转移电子是2mol,当转移2mol电子时,根据电解反应:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2,Cu2O的生成量为1mol,质量为144g,
故答案为:2H++2e-=H2↑;144.
(4)钢铁船体在海水中易发生电化学腐蚀中的吸氧腐蚀,可以利用原电池原理牺牲阳极的阴极保护法进行保护;在电解池中,阴极是被保护的电极,可以把船体与浸在海水里的Zn块相连,并与电源的负极相连,
故答案为:负.
点评 本题考查学生有关电化学和热化学的知识,注意热化学方程式书写和电极反应式书写,综合性较强,难度中等.


科目:高中化学 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
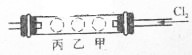 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| 键能(KJ•mol-1) | 436 | 326 | 803 | 464 | 414 |
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时容器内的压强是原来的0.8倍 | |
| B. | M的平均反应速率为0.15 mol•L-1•min-1 | |
| C. | x的值为1 | |
| D. | 平衡时P的浓度为0.25 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com