
科目:高中化学 来源:2016届福建省莆田市高三上学期期中测试化学试卷(解析版) 题型:选择题
将下图所示实验装置的K闭合,下列判断正确的是

A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源:2016届河南省南阳市高三上学期第一次联考化学试卷(解析版) 题型:选择题
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO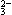 、SO
、SO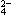 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测不正确的是
A.K+一定存在
B.100mL溶液中含0.01mol CO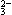
C.Cl-可能存在
D.Ba2+和Cl-一定不存在
查看答案和解析>>
科目:高中化学 来源:2016届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:填空题
无水氯化铝在生产、生活中应用广泛。
I、(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 .
II、工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
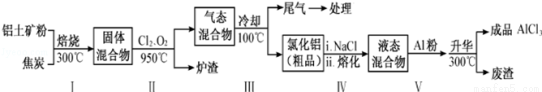
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
(2)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种).
(3)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是
(4)已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) △H1=+1344.1kJ•mol﹣1
2AlCl3(g)=2Al(s)+3Cl2(g) △H2=+1169.2kJ•mol﹣1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
(5)步骤Ⅲ的经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为
(6)结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是
查看答案和解析>>
科目:高中化学 来源:2016届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.NH4+、Ba2+、Br﹣、CO32﹣
B.Cl﹣、SO32﹣、Fe2+、H+
C.K+、Na+、SO42﹣、MnO4﹣
D.Na+、H+、NO3﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源:2016届四川省广元市高三上学期第二次阶段测理综化学试卷(解析版) 题型:填空题
硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)NaBH4中H元素的化合价为 。
请配平第①步反应的化学方程式,并用单线桥标出电子转移的方向和数目:
□NaBO2+□SiO2+□Na+□H2 □NaBH4+□Na2SiO3
□NaBH4+□Na2SiO3
(2) 实验室取用少量金属钠需要用到的实验用品有 、滤纸、玻璃片和小刀等。
在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 。
(3)第②步分离采用的方法是 。
第③步分出NaBH4并回收溶剂,采用的方法是 。
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和氢气(g),在25℃,101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016届四川省广元市高三上学期第二次阶段测理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L HF含有的HF分子数为0.1NA
B.在常温常压下,32 g 18O2中含有2NA氧原子
C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期期中测试化学试卷(解析版) 题型:实验题
氯化铁是常见的水处理剂。某氯化铁(FeCl3·6H2O)样品含有少量FeCl2杂质。现要测定其中FeCl3·6H2O的质量分数,实验按以下步骤进行:

已知有关离子方程式为:2Fe3+ +2I-==2Fe2++ I2 , I2+2S2O32-==2I- +S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻液体呈现红褐色,反应的离子方程式为: 。
(2)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称)。
(3)操作Ⅱ必须用到的仪器是 (选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
(4)指示剂是淀粉溶液,则达到滴定终点的现象是 。
(5)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3 溶液18.17mL。该样品中FeCl3·6H2O的质量分数为 。
(6)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是 (选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com