
分析 【探究一】(1)常温下,铁和浓硫酸发生钝化现象;
(2)①可用铁氰化钾溶液检验亚铁离子;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以2.33g沉淀是BaSO4,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(BaSO4)=n(S)=n(SO2)=0.01mol,标况下二氧化硫体积=0.01mol×22.4L/mol=224mL;
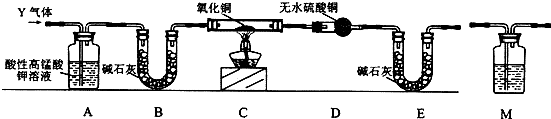
【探究二】装置图分析可知,气体通过高锰酸钾溶液除去二氧化硫,装置B装置干燥气体并吸收二氧化碳、二氧化硫,C装置是还原氧化铜生成铜,D是检验生成的水蒸气,E防止空气中水蒸气进入干扰检验,以此解答该题.
解答 解:(1)常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以将铁钉放入浓硫酸片刻无明显变化的原因是铁钉表面被钝化,故答案为:铁钉表面被钝化;
(2)①a.铁离子和KSCN溶液反应导致溶液呈血红色,但不能确定原来溶液中一定含有亚铁离子,故错误;
b.用铁氰化钾溶液与亚铁离子反应生成沉淀,可检验,故正确;
c.盐酸与亚铁离子、铁离子都不反应,故错误;
故选b;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-,硫酸和氯化钡反应生成硫酸钡沉淀,所以2.33g沉淀是BaSO4,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(BaSO4)=n(S)=n(SO2)=0.01mol,标况下二氧化硫体积=0.01mol×22.4L/mol=224mL,二氧化硫体积分数=$\frac{224mL}{448mL}×100%$=50%,
故答案为:SO2+Br2+2H2O═4H++2Br-+SO42-;50%;
【探究二】装置图分析可知,气体通过高锰酸钾溶液除去二氧化硫,装置B装置干燥气体并吸收二氧化碳、二氧化硫,C装置是还原氧化铜生成铜,D是检验生成的水蒸气,E防止空气中水蒸气进入干扰检验,
(3)二氧化硫具有还原性,可与高锰酸钾发生氧化还原反应而被除去,可观察到A中溶液颜色变浅,
故答案为:溶液颜色变浅;除去二氧化硫并检验二氧化硫是否除尽;
(4)为检验二氧化碳,可在用碱石灰除杂之前用澄清石灰水检验,则M应放在A~B之间,生成二氧化碳的反应为反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,有方程式可知反应中氧化剂与还原剂的物质的量之比为2:1,
故答案为:b;2:1;
(5)若C中固体变红,D中固体变蓝,说明生成水,则Q是H2,产生氢气的原因是随着反应的进行,浓硫酸变稀,铁与稀硫酸反应生成氢气,
故答案为:H2;随着反应的进行,浓硫酸变稀,铁与稀硫酸反应生成氢气;
(6)①现测知该气体中含氧质量分数为50%,而SO2中氧元素的质量分数正好为:50%,所以该气体有可能是纯净物SO2
②CO2中氧元素的质量分数为72.7%比50%大,但如果和一定量的H2混合,总的氧元素的质量分数就会比72.7%小,可能达到50%,所以该气体有可能是CO2和H2的混合物;
③还有可能是三者的混合物,因为SO2中氧元素的质量分数正好为:50%,与该气体中氧元素的质量分数相同,对总的含氧量不影响;而CO2和H2混合,氧元素的质量分数比72.7%小,可能达到50%,所以该气体有可能是SO2、H2、CO2的混合物;
④如果是SO2和H2混合;或单独是H2,氧元素的质量分数就会比50%小;如果是SO2和CO2混合;或单独是CO2氧元素的质量分数比72.7%大,所以都不符合,则有三种情况:①SO2:②CO2和H2的混合物;③SO2、H2、CO2的混合物满足,即选项ace正确,
故答案为:ace.
点评 本题考查以铁和浓硫酸反应为载体考查性质实验方案设计,侧重考查实验操作、物质检验、离子检验等知识点,明确实验原理及各个装置作用是解本题关键,注意二氧化硫、二氧化碳、水蒸气检验先后顺序,要排除外界因素的干扰,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HNO3、KOH、FeCl3 | B. | K2SO4、KCl、HCl | ||
| C. | AgNO3、HCl、KCl | D. | Na2CO3、KCl、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 CH3COOCH(CH3)2+H2O,取代反应或酯化反应反应类型
CH3COOCH(CH3)2+H2O,取代反应或酯化反应反应类型查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫磺有杀虫、杀螨、杀菌作用 | |
| B. | 石膏可以用做雕像材料 | |
| C. | 碳酸钡常用于治疗胃病,俗称“钡餐” | |
| D. | 明矾可做净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
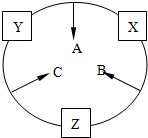 原子序数之和为16的三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素x、y、z对应的单质 X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如图所示的变化.已知B分子组成中z原子个数比C分子中少一个. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
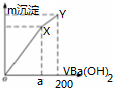
| A. | a=150 | |
| B. | Y点对应溶液为氨水 | |
| C. | OX、XY两段沉淀种类相同 | |
| D. | 继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能导电的有①②⑤⑥ | |
| B. | 属于电解质的有⑤⑦⑧ | |
| C. | 属于强电解质的有⑤⑥⑧ | |
| D. | 既不属于电解质又不属于非电解质的有①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com