
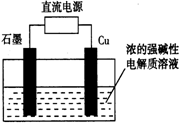
 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氢气 | B. | 铜电极发生还原反应 | ||
| C. | 铜电极接直流电源的负极 | D. | 该反应也可设计为原电池 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 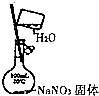 配置一定物质的量 浓度的NaNO3溶液 | |
| B. | 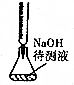 中和滴定 | |
| C. | 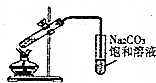 制备乙酸乙酯 | |
| D. | 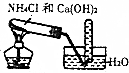 实验室制取氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是非电解质 | B. | A是强电解质 | C. | A是共价化合物 | D. | A是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
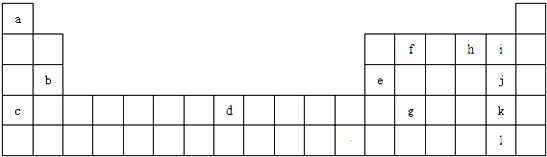
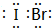 ,它是由σ键形成的(根据原子轨道的重叠程度填写).
,它是由σ键形成的(根据原子轨道的重叠程度填写).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
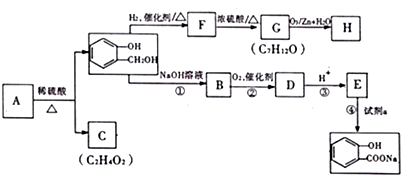
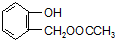 ,C含有的官能团是羧基;由F到G的反应类型为消去反应.
,C含有的官能团是羧基;由F到G的反应类型为消去反应.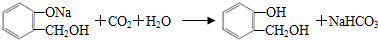 ;合适的试剂a为NaHCO3溶液.
;合适的试剂a为NaHCO3溶液.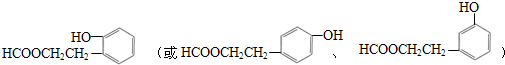 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
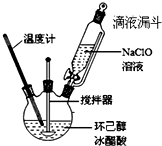 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.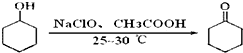
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com