
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.96×10-5 |
| HClO | HClO?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.6×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
分析 (1)由盖斯定律可知,②×2-①×2得2CH4(g)+O2(g)═2CO(g)+4H2(g)以此计算△H;
(2)正极是MnO2得到电子发生还原反应生成Mn2O3,负极镁失电子生成的镁离子和氢氧根结合生成氢氧化镁沉淀;
(3)前5min 内生成CaO的质量为11.2g,n(CO)=n(CaO)=$\frac{11.2g}{56g/mol}$=0.2mol,则v(CO)=$\frac{0.2mol}{1L×5min}$=0.04mol•L-1•min-1;温度不变,平衡常数不变,t0时刻,将容器体积缩小为原来的一半并固定不变,c(CO2)=2c,在t1时刻再次达到平衡时,c(CO2)=c,作图即可;
(4)酸越弱对应阴离子的水解程度越大溶液碱性越大,酸式盐的电离程度和水解程度大小比较;
(5)向NaClO溶液中通入过量的二氧化碳,反应生成次氯酸和碳酸氢钠;
(6)依据溶度积常数计算;
解答 解:(1)①C(s)+2H2(g)═CH4(g)△H1=a kJ•mol-1;
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=b kJ•mol-1;
依据盖斯定律:②×2-①×2得2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=2(b-a)kJ•mmol-1;
故答案为:2(b-a)kJ•mmol-1;
(2)正极是MnO2得到电子发生还原反应生成Mn2O3,负极镁失电子生成的镁离子和氢氧根结合生成氢氧化镁沉淀,Mg-2e-+2OH-=Mg(OH)2,
故答案为:还原;Mg+2OH--2e-=Mg(OH)2;
(3)前5min 内生成CaO的质量为11.2g,n(CO)=n(CaO)=$\frac{11.2g}{56g/mol}$=0.2mol,则v(CO)=$\frac{0.2mol}{1L×5min}$=0.04mol•L-1•min-1;温度不变,平衡常数不变,t0时刻,将容器体积缩小为原来的一半并固定不变,c(CO2)=2c,在t1时刻再次达到平衡时,c(CO2)=c,作图如下: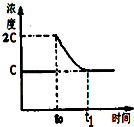 ,
,
故答案为:0.04mol•L-1•min-1; ;
;
(4)依据酸的电离平衡常数大小比较得到酸性强弱为:H3PO4>CH3COOH>H2CO3>HClO>H2PO4->HCO3->HPO42-,对应生成盐的水解程度大小为:H2PO4-<CH3COO-<HCO3-<ClO-<HPO42-<CO32-<PO43-,则pH最大的是Na3PO4,pH最小的是NaH2PO4 ,
故答案为:Na3PO4;NaH2PO4;
(5)向NaClO溶液中通入过量的二氧化碳,发生的离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,
故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(6)取一定量主要含有I-、Cl-等离子溶液,向其中滴加AgNO3溶液,当AgCl开始沉淀时氯化银和碘化银共存,则$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{c({I}^{-})}{c(C{l}^{-})}$×$\frac{c(A{g}^{+})}{c(A{g}^{+})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.8×1{0}^{-10}}$=4.7×10-7,
故答案为:4.7×10-7;
点评 本题考查盖斯定律、化学反应速率和图象的应用、弱酸电离平衡的性质、溶度积常数计算等知识,综合性较强,难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
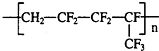 ,合成它的单体为( )
,合成它的单体为( )| A. | CH2=CF2-CF2和CF=CF3 | B. | CH2=CF2和CF2=CF-CF3 | ||
| C. | CH2=CF2=CF2=CF-CF3 | D. | CH2=CF2-CF2=CF-CF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳极易与血红蛋白结合,所以有毒 | |
| B. | 氧气易溶于水,所以鱼能生存 | |
| C. | 金刚石和石墨都是碳元素组成的单质,所以性质相似 | |
| D. | 溶液由溶质和溶剂组成,所以溶液体积等于溶质体积加溶剂体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
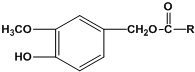 (R为烃基)
(R为烃基)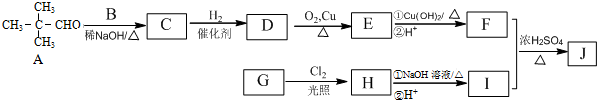
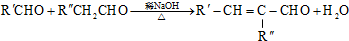
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
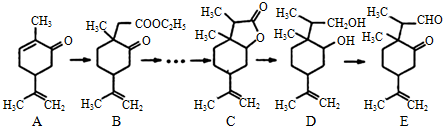
 .
.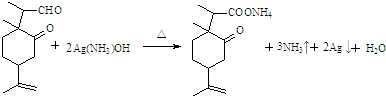 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
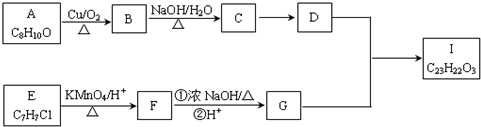
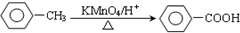
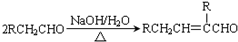
 .
. .
.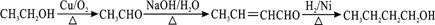 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O 取代反应 | |
| B. | CH2=CH2+Br2→CH2Br-CH2Br 加成反应 | |
| C. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl 置换反应 | |
| D. | CH4$\frac{\underline{\;高温\;}}{\;}$C+2H2 氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com