
【题目】(1)在标准状况下,5.6L A气体的质量是15g,则A的摩尔质量为___。
(2)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为:XY2(液)+ 3O2(气)= XO2(气)+2YO2(气),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是______。
②化合物XY2的摩尔质量是____。
③若XY2分子中X、Y两元素的质量之比为3:16,则X、Y两元素分别是_____和_____。(写元素符号)
【答案】60g/mol 672ml 76g/mol C S
【解析】
(1)结合n=![]() 计算A气体的物质的量,再根据M=
计算A气体的物质的量,再根据M=![]() 计算即可;
计算即可;
(2)①XY2(液)+3O2(气)=XO2(气)+2YO2(气),结合化学方程式定量关系计算氧气的物质的量;
②从质量守恒的角度分别计算XY2的物质的量和质量,进而计算摩尔质量;
③根据XY2的摩尔质量和X、Y两元素的质量之比计算X、Y的相对原子质量,进而可判断元素的种类,写出化学式。
(1)5.6L A气体的物质的量n=![]() =
=![]() =0.25mol,则A的摩尔质量M=
=0.25mol,则A的摩尔质量M=![]() =
=![]() =60g/mol;
=60g/mol;
(2)生成物总物质的量为n(XO2)+n(YO2)=![]() =0.03mol,由方程式可知,n(XO2):n(YO2)=1:2,则n(XO2)=0.01mol,n(YO2)=0.02mol,总质量为:m(XO2)+m(YO2)=0.672L×2.56g/L=1.72g;
=0.03mol,由方程式可知,n(XO2):n(YO2)=1:2,则n(XO2)=0.01mol,n(YO2)=0.02mol,总质量为:m(XO2)+m(YO2)=0.672L×2.56g/L=1.72g;
①设消耗的氧气的物质的量为n(O2),则:
XY2(l)+3O2(g)=XO2(g)+2YO2(g)
1mol 3mol 1mol 2mol
n n(O2) 0.01mol 0.02mol
n=0.03mol;
②根据质量守恒可知:m(XY2)+m(O2)=m(XO2)+m(YO2)=1.72g,m(O2)=0.03mol×32g/mol=0.96g,m(XY2)=1.72g-0.03mol×32g/mol=0.76g,又:n(XY2)=0.01mol,则:M(XY2)=![]() =76g/mol;
=76g/mol;
(3)在XY2分子中,X、Y两元素的质量之比为3:16,
则1molXY2分子中,X的质量为76g×![]() =12g,Y的质量为:76g-12g=64g,有1molXY2分子中含有1molX,2molY,所以:X的相对原子质量为12,Y的相对原子质量为
=12g,Y的质量为:76g-12g=64g,有1molXY2分子中含有1molX,2molY,所以:X的相对原子质量为12,Y的相对原子质量为![]() =32,则X为C元素,Y为S元素。
=32,则X为C元素,Y为S元素。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】钋(Po)是一种低熔点金属,极其稀有,毒性和放射性极强。回答下列问题:
(1)![]() Po具有放射性,经
Po具有放射性,经![]() 衰变成稳定的铅,在衰变过程中释放一个
衰变成稳定的铅,在衰变过程中释放一个![]() He2+,Pb的原子核中质子数为____,中子数为____,Po元素能形成较稳定的+4价离子,wg
He2+,Pb的原子核中质子数为____,中子数为____,Po元素能形成较稳定的+4价离子,wg![]() Po4+含有的电子的物质的量为____;
Po4+含有的电子的物质的量为____;
(2)半衰期是指由大量原子组成的放射性样品中,放射性元素原子核有50%发生衰变所需的时间,已知![]() Po的半衰期为138天,质量为64克的
Po的半衰期为138天,质量为64克的![]() Po,经276天后,得到铅的质量为____。
Po,经276天后,得到铅的质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是
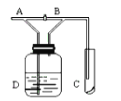
A. 浓硫酸B. NaOH溶液C. 水D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:
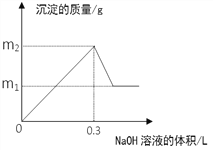
A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国新型火箭长征5号采用液氢和液氧作为推进剂。有关说法不正确的是( )
A.将氢、氧液化可增加火箭携带燃料总量
B.火箭依靠氢气和氧气燃烧放出的热推进
C.拆开氢、氧分子中的化学键需要吸收能量
D.燃料的总能量小于燃烧产物水的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法不正确的是
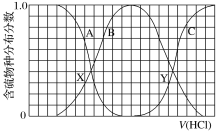
A. X、Y为曲线两交叉点。由X点处的pH,可计Ka1(H2S)
B. Y点对应溶液中c(Na+)与含硫各微粒浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C. X、Y点对应溶液中水的电离程度大小关系为:X > Y
D. 已知NaHS呈碱性,若向溶液中加入CuSO4溶液至恰好完全反应,所得溶液呈强酸性。其原因是Cu2++HS-=CuS↓+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃在氧气中完全燃烧,生成物先通过浓硫酸,再通过碱石灰,如果生成物完全全被二者吸收,浓硫酸增重27g,碱石灰增重44g。该有机物的化学式为
A.CH4B.C2H6C.C3H8D.C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com